 |
Занятие № 12. 1. Тестовый контроль знаний по теме «Растворы электролитов. Электрохимические системы. Кинетика электродных растворов».
|
|
|
|
Занятие № 12.
План занятий:
1. Тестовый контроль знаний по теме «Растворы электролитов. Электрохимические системы. Кинетика электродных растворов».
2. Лабораторная работа.
1. Тестовый контроль знаний по теме «Растворы электролитов. Электрохимические системы. Кинетика электродных растворов».


 1. Изотонический коэффициент не зависит от
1. Изотонический коэффициент не зависит от
1. природы электролита.
2. природы растворителя.
3. температуры.
4. давления.
2. Меняется ли степень диссоциации слабого электролита в водном растворе с ростом температуры?
1. Увеличивается с ростом температуры.
2. Уменьшается с ростом температуры.
3. Не меняется.
4. Проходит через максимум с ростом температуры.
3. Каковы причины диссоциации электролитов в растворе на ионы?
1. Химическое взаимодействие с растворителем.
2. Физическое взаимодействие с растворителем.
3. Энергетическое состояние электролита.
4. Химическое и физическое взаимодействие с растворителем.
4. Изменяется ли и как константа диссоциации слабого электролита, если в качестве растворителя вместо воды взять метиловый спирт (химическое взаимодействие с растворителем отсутствует)?
1. Остается неизменной.
2. Увеличивается.
3. Уменьшается.
4. Меняется произвольно.
5. Какие из следующих пар указанных величин не влияют на электропроводность электролитов?
1. Концентрация и температура.
2. Температура и радиус иона.
3. Вязкость раствора и постоянная сосуда.
4. Постоянная сосуда и площадь электрода.
6. Какую закономерность не отражает закон разведения Оствальда?
1. Влияние разведения на степень диссоциации электролита.
2. Влияние разведения на константу диссоциации электролита.
|
|
|
3. Влияние температуры на степень и константу диссоциации электролита.
4. Форму записи процесса диссоциации электролита.
7. Какие из следующих факторов влияют на молярную электропроводность электролита?
1. Площадь электродов.
2. Природа электродов.
3. Постоянная сосуда для измерения электропроводности.
4. Радиус иона.
8. Эквивалентная электропроводность водного раствора электролита максимальна...
1. в его насыщенном растворе.
2. в его пересыщенном растворе.
3. при бесконечном разведении.
4. в его разбавленном растворе.
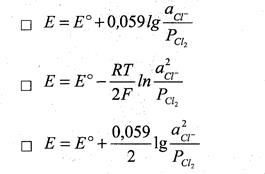
 9. Уравнение Нернста для потенциала хлорного электрода (Е) при небольших давлениях газообразного хлора (РСl2 )….
9. Уравнение Нернста для потенциала хлорного электрода (Е) при небольших давлениях газообразного хлора (РСl2 )….
10. Масса вещества, выделяющегося на электроде при электролизе….
1. не зависит от времени.
2. увеличивается со временем.
3. уменьшается со временем.
4. может увеличиваться или уменьшаться в зависимости от природы вещества.
Задача №1. Раствор, содержащий в 25 г воды 0, 608 г бензойной кислоты, кипит при 100, 104 °С. Эбуллиоскопическая постоянная воды 0, 512. К слабым или сильным электролитам относится бензойная кислота?
Задача №2. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли, если раствор, содержащий в 100 г воды 2, 25 г сульфата натрия, кипит при температуре 100, 186 °С. Эбуллиоскопическая постоянная воды 0, 512.
Задача №3. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли, если раствор, содержащий в 100 г воды 2, 25 г сульфата натрия, кипит при температуре 100, 186 °С. Эбуллиоскопическая постоянная воды 0, 512.
Задача №4. Сопротивление 0, 307 н. раствора нитрата серебра при 18 °С равно 404, 3 ом. Сопротивление 0, 02 н. раствора хлорида калия в том же сосуде при тех же условиях равно 4318 ом, а удельная электропроводимость его χ = 0, 002397 ом-1см-1. Вычислите удельную и эквивалентную электропроводимость раствора нитрата серебра.
|
|
|
Задача №5. Постоянная сосуда для определения сопротивления растворов равна 4, 264 см-1. Вычислите сопротивление 0, 2 н. раствора нитрата калия, измеренное в этом сосуде при 18 °С. Эквивалентная электропроводимость этого раствора равна 98, 7 ом-1см2.
Задача №6. Удельная электропроводимость 30%-ного раствора соляной кислоты при 18 °С равна 0, 662 ом-1 см-1, плотность этого раствора равна 1, 152 г/см3. Определите эквивалентную электропроводимость раствора.
Задача №7. Используя справочные данные, вычислите ЭДС для элемента Pt|H2|HCl|Cu3(PO4)2|Cu и изменение энергии Гиббса для процесса, протекающего при 298 К.
Задача №8. Используя справочные данные, вычислите ЭДС для элемента Zn|Zn2+||Ag+|Ag и изменение энергии Гиббса для процесса, протекающего при 298 К.
Задача №9. Ток силой 1, 5 А выделяет из раствора сульфата кадмия в течение 40 мин 2, 283 г кадмия. Вычислите эквивалент этого металла. Какое вещество и в каком количестве выделилось на угольном аноде? Условия нормальные.
Задача №10. Сколько кулонов электричества надо пропустить через раствор для никелирования, чтобы утюг поверхностью 500 см2 покрылся слоем никеля толщиной 0, 015 мм, если плотность никеля равна 8, 8 г/см3?
|
|
|


