 |
Тестовое задание считается выполненным, если решена задача и даны 6 правильных ответов на тестовые вопросы.
|
|
|
|
Тестовое задание считается выполненным, если решена задача и даны 6 правильных ответов на тестовые вопросы.
Занятие № 13.
План занятия:
Лабораторная работа.
Занятие № 14.
План занятия:
Лабораторная работа.
Занятие №15.
План занятий:
1. Кинетика химических реакций.
2. Решение задач на тему «Кинетика химических реакций».
1. Кинетика химических реакций.
Химическая кинетика – раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т. е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики – законом действующих масс.
Для реакции aA + bB ® dD + eE
 , где k - константа скорости (не зависящая от концентрации); x, y – некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней n = x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
, где k - константа скорости (не зависящая от концентрации); x, y – некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней n = x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
Скорость химической реакции зависит от температуры. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения – правило Вант-Гоффа и уравнение Аррениуса.
|
|
|
Правило Вант-Гоффа заключается в том, что при нагревании на 10 оС скорость большинства химических реакций увеличивается в 2¸ 4 раза.
 , где γ - температурный коэффициент скорости (γ = 2¸ 4).
, где γ - температурный коэффициент скорости (γ = 2¸ 4).
Уравнение Аррениуса, описывает температурную зависимость константы скорости:  , где R – дуниверсальная газовая постоянная; A – предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; EA – энергия активации, которую можно охарактеризовать как некоторую пороговую энергию: т. е., если энергия сталкивающихся частиц меньше EA, то при столкновении реакция не произойдет, если энергия превышает EA, реакция произойдет. Энергия активации не зависит от температуры.
, где R – дуниверсальная газовая постоянная; A – предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; EA – энергия активации, которую можно охарактеризовать как некоторую пороговую энергию: т. е., если энергия сталкивающихся частиц меньше EA, то при столкновении реакция не произойдет, если энергия превышает EA, реакция произойдет. Энергия активации не зависит от температуры.
Зависимость константы скорости реакции от концентрации и времени описывают кинетические уравнения, вид которых зависит от порядка реакции.
Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации.
Реакции 1-го порядка. В реакциях типа A ®B скорость прямо пропорциональна концентрации:  .
.
Время, за которое распадается половина вещества A, называют периодом полураспада τ 1/2. Для реакции 1-го порядка период полураспада определяется уравнением 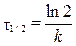 .
.
Реакции 2-го порядка. В реакциях типа A + B® D +... скорость прямо пропорциональна произведению концентраций
Для реакций 2-го порядка различают два случая.
1) одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид:  .
.
Период полураспада веществ A и B одинаков и равен:  .
.
2) начальные концентрации веществ A и B различны: a≠ b.
 .
.
Периоды полураспада веществ A и B различны: τ 1/2 (А) ≠ τ 1/2(В).
Реакции n-го порядка. Для реакций типа nA ® D +... Кинетическое уравнение имеет вид:
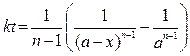 .
.
Период полураспада вещества A обратно пропорционален (n-1)-ой степени начальной концентрации: 
|
|
|


