 |
Занятие № 16. 1. Тестовый контроль знаний по теме «Химическая кинетика». 1. От каких факторов зависит величина константы скорости химической реакции?
|
|
|
|
Занятие № 16.
План занятия:
1. Тестовый контроль знаний по теме «Химическая кинетика».
2. Коллоквиум на тему: «Электрохимия. Химическая кинетика».
3. Повторение пройденного материала.
1. Тестовый контроль знаний по теме «Химическая кинетика».
1. От каких факторов зависит величина константы скорости химической реакции?
1. концентрации, температуры, катализатора, природы реакции;
2. температуры, катализатора;
3. температуры, катализатора, природы реакции и ее механизма;
4. концентрации, катализатора.
2. Какое из уравнений соответствует обратимой реакции первого порядка?
1. 
 ; 2.
; 2.  ;
;
3.  ; 4.
; 4.  .
.
3. Какое из приведенных уравнений является уравнением Аррениуса?
1.  ; 2.
; 2. 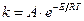 ;
;
3.  ; 4.
; 4.  .
.
4. Некоторая гетерогенная реакция протекает по нулевому порядку. Как зависит скорость этой реакции от концентрации реагирующих веществ?
1. С ростом концентрации скорость реакции увеличивается;
2. С ростом концентрации скорость реакции уменьшается;
3. Скорость реакции не зависит от концентрации реагентов;
4. Невозможно ответить на вопрос, не зная природы реагирующих веществ.
5. Выберите графическую зависимость концентрации продукта реакции от времени в случае реакции нулевого порядка.
1. 2. 3. 4.
 С С С С
С С С С
τ τ τ τ
|
|
|
6. Могут ли порядок и молекулярность быть дробными величинами?
1. Ни молекулярность, ни порядок не могут быть дробными числами;
2. И порядок, и молекулярность могут быть дробными величинами;
3. Порядок – может, молекулярность – нет;
4. Молекулярность – может, порядок – нет.
7. Какие параметры определяют численное значение температурного коэффициента скорости реакции?
1. Отношение констант скоростей прямой и обратной реакции;
2. Энергия активации и температура реакции;
3. Тепловой эффект реакции;
4. Скорость реакции при данной температуре.
8. Укажите выражение для константы скорости реакции первого порядка.
1. К =  ; 2. К =
; 2. К =  ; 3. К =
; 3. К =  ; 4. К =
; 4. К =  .
.
9. Укажите графическую зависимость константы скорости реакции от концентрации исходных веществ.
1. 2. 3. 4.
 k k k k
k k k k
c c c c
10. Что называется порядком химической реакции?
1. Число молекул, участвующих в элементарном химическом акте.
2. Сумма показателей степеней в математическом выражение закона действующих масс для сложной реакции.
3. Показатель степени в которую возводится концентрация одного из исходных веществ
4. Скорость реакции при концентрациях реагирующих веществ, равных 1.
Ответы:
Занятие № 1.
3-1. 324, 2 кПа. 3-2. 3, 527 раз. 3-3. 300 °С. 3-4. не измениться; 40 % О2, 40 % Н2О, 20 % СО2. 3-5. 1577 л. 3-6. 0, 673 л. 3-7. 74, 5 г/моль. 3-8. 78 г/моль; С6Н6.
3-9. 4, 3 л. 3-10. Р(О2) = 80 кПа, Р(N2) = 300 кПа, Р(NН3) = 60 кПа, Р = 440 кПа. 3-11. 6, 18 г; Р(О2) = 48, 4 кПа, Р(N2) = 120, 5 кПа, Р(СО2) = 33, 8 кПа.
3-12. 55, 78 кПа. 3-13. 226, 5 кПа. 3-14. 205 К; 616 К. 3-15. 509 м/сек.
4-1. 300, 3 К, 245, 7 К. 4-2. а) 0, 82, б) 1, 18. 4-3. 100 км/час. 4-4. 38, 9%. 4-5. 1: 1.
|
|
|
4-6. 28, 5 %.
5-1. Р2 = 7/9Р1; 28, 6 % СО, 42, 8 % Сl2, 28, 6 % СОСl2. 5-2. а) Р2 = 5/6Р1;
б) Р2 = 5/4Р1. 5-3. 41, 6 % NО; 58, 4 % СО2. 5-4. Р(О2) = 14, 7 кПа,
Р(СН4) = 23, 5 кПа, Р = 38, 2 кПа, 38, 5 % О2. 5-5. 12, 6 л. 5-6. Р(О2) = 24 кПа, Р(N2) = 8 кПа, Р(Ar) = 48 кПа. 5-7. 6, 36. 5-8. 1, 01 кПа. 5-9. 3737 Дж.
5-10. 128 °С. 5-11. 7, 73∙ 10-21 Дж.
Занятие № 2.
3-1. 1470 Дж. 3-2. -481, 8 Дж. 3-3. W = 12156 Дж, Q = 42546 Дж, Δ U = 0.
3-4. W = Q = 7419 Дж. 3-5. 5740 Дж. 3-6. 3652 Дж. 3-7. 74, 2 Дж. 3-8. 324 кПа, 1670 Дж. 3-9. 4567 Дж. 3-10. 754 К, -3829 Дж. 3-11. 935, 2 Дж. 3-12. -1038, 7 Дж. 3-13. 192 кДж.
4-1. 37, 1 кДж. 4-2. 181, 6 кДж, 51, 66 кДж. 4-3. 1, 22 л. 4-4. 8, 6 кДж. 4-5. 709, 1 Дж. 4-6. 325 кПа, 1665 Дж.
5-1. 4 кДж, 4 кДж. 5-2. 29, 3 Дж, 31, 7 л. 5-3. Q = 2909 Дж, Δ U = 2078 Дж.
5-4. W = Q = 2593 Дж. 5-5. 20, 8 Дж. 5-6. Т2 = 184 К, V2 = 45, 3 л,
W = -Δ U = 6245 Дж. 5-7. для адиабатического процесса: Т1 =244 К, Т2 =97, 6 К, V2 = 4 л, W = -Δ U = 918 Дж; для изотермического процесса: Т1 = Т2 = 244 К,
V2 = 10 л, W = 1216 Дж, Δ U = 0. 5-8. 6, 1 кДж. 5-9. W = 3, 76 кДж,
Δ U = 35, 76 кДж. 5-10. N2.
Занятие № 3.
3-2. 1, 88 кДж/моль. 3-5. а) -240, 7 кДж; б) -43, 74 кДж; в) -268, 8 кДж;
г) 32, 66 кДж. 3-6. 160, 7 кДж/моль. 3-7. 13, 3 кДж. 3-8. 36, 7 кДж/моль.
3-9. -981, 4 кДж/моль.
4-1. 28 кДж.
5-3. - 423, 7 кДж.
Занятие № 4.
3-1. 9, 57 Дж. 3-2. 4, 41 Дж. 3-3. 1, 15 Дж. 3-4. -19, 12 Дж. 3-5. 3, 26 Дж.
3-6. 724 Дж. 3-7. 11, 5 Дж. 3-8. 17 Дж.
4-1. 21, 6 Дж/К. 4-2. 170 Дж/К. 4-3. 11, 88 Дж/К.
5-1. 41, 7 Дж/К. 5-2. 2, 42∙ 103 Дж/К; 4, 04∙ 103 Дж/К. 5-3. 62 кДж/К. 5-4. 5, 5 кДж/К. 5-5. 6, 3 кДж/К. 5-6. -15, 16 кДж/К. 5-7. 233 кДж/К. 5-8. 8, 7∙ 10-2 Дж.
5-9. 142 кДж/К.
Занятие № 5.
3-4. 24 % Н2, 44 % Сl2, 32 % НСl. 3-5. Кр =Кс = 0, 02. 3-6. Кр = 92000.
3-7. 69 кПа. 3-8. Кр = 1, 08∙ 105. 3-9. Кр = 1, 7. 3-10. а) да; б) нет; в) состояние равновесия. 3-11. 34, 4 кДж/моль.
4-1. 0, 64. 4-2. уменьшилось в 3 раза. 4-3. 1, 55 моль. 4-4. 83, 3 %. 4-5. Н2 больше в 13 раз, N2 в 3 раза. 4-6. 251.
5-1. Кс = 51, 2; С0(Н2)= 1, 3 моль/л, С0(Br2)= 0, 9 моль/л. 5-2. 12, 5 %, 5470 кПа.
5-3. 2, 03∙ 10-3. 5-4. 0, 696. 5-5. 35, 15 кПа. 5-6. 1, 6∙ 10-3. 5-7. 1823 кПа. 5-8. 9, 65 г; Р(НI) =145, 9 кПа; Р(I2) =3, 04 кПа; Р(Н2) =120, 5 кПа. 5-9. 2. 22. 5-10. 23400 кПа.
Занятие № 9.
3-1. 10 кПа. 3-2. 4, 94 %. 3-3. 57, 5 кПа. 3-4. 119, 6 г/моль; 2, 04 %. 3-5. 260, 5.
3-6. 0, 6 кПа. 3-7. 7, 39 Дж; 111, 37 Дж. 3-8. 184, 1. 3-9. 1, 5 %. 3-10. 100, 054.
4-1. 0, 6 кПа. 4-2. 3, 1 кПа. 4-3. 178, 4; 1 %. 4-4. -0, 442°С. 4-5. -3°С. 4-6. 8.
5-1. 97, 4 кПа. 5-2. 38 г. 5-3. 243, 9 г/моль. 5-4. 101°С; 93, 7 кПа. 5-5. 1, 857; 1, 859. 5-6. -0, 3876 °С. 5-7. -0, 372 °С. 5-8. 105, 3; 0, 75 %. 5-9. 154, 9; 1, 75 %. 5-10. 0, 51; 0, 512.
Занятие № 10.
3-1. 20, 91 кПа; χ п(СНСl3)=0, 635. 3-2. χ р(С2Н4Br2)=0, 802; χ п(С2Н4Br2)=0, 425.
|
|
|
3-3. 1) 27, 78 % С6Н6; 2) 66, 7 % С6Н6. 3-4. 3, 4∙ 10-3. 3-5. 2, 26; 2, 04. 3-6. 142, 1 кПа. 3-7. 41, 8 кПа. 3-8. 1) 12 % и 88 % ССl4; 36 % и 82 % ССl4; 2) 62 % ССl4; 63, 8 °С. 3-9. 1) 75 % ССl4; 2) 35 % ССl4. 3-10. 1)жидкость 65 % СН3СООН; пар 50 % СН3СООН; 2) 113 °С, 111 °С; 87 % СН3СООН.
4-1. 9, 41 кПа, χ п(СН3ОН)=0, 742. 4-2. 29, 4 кПа, χ п(С6Н6)=0, 742. 4-3. 67 % N2 и
33 % О2. 4-4. 147, 2 кПа. 4-5. 1) 44 % и 87 % СНСl3; 36 % и 93 % СНСl3; 2) 63 % СНСl3; 63, 8 °С. 4-6. 1) жидкость 47 % ССl4, пар 23 % ССl4; 2) 62 °С, 15 % ССl4.
5-1. χ ж(С6Н5Сl)=0, 591, χ п(С6Н5Сl)=0, 731. 5-2. 1) 4, 9 кПа, 16, 5 кПа, 21, 4 кПа; 2) 13, 6 кПа, 9, 1 кПа, 22, 7 кПа. 5-3. 729 г. 5-4. 0, 284 г. 5-5. 29, 8 кПа. 5-6. 356, 5 кПа. 5-7. 1а) 36, 7 кПа, 38, 7 кПа, 75, 0 кПа; 1б) 54, 0 кПа, 32, 0 кПа, 86, 0 кПа; 2) 28 % и 94 % СS2. 5-8. Азеотропная смесь. 5-9. 1) 115 °С, 54 % НNО3; 2) жидкость 98 % НNО3, пар 70 % НNО3; 3) НNО3 и азеотропная смесь. 5-10. 14 % ССl4, 100 % С2Н5ОН.
|
|
|


