 |
Тестовое задание считается выполненным, если решена задача и даны 6 правильных ответов на тестовые вопросы.
|
|
|
|
Тестовое задание считается выполненным, если решена задача и даны 6 правильных ответов на тестовые вопросы.
2. Растворы электролитов. Электрохимические системы. Кинетика электродных растворов.
Переносчиками электрического тока в растворах электролитов являются ионы, образующиеся при диссоциации молекул электролитов. Поскольку при диссоциации число частиц в растворе возрастает, растворы электролитов обладают аномальными коллигативными свойствами.
Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств идеальных растворов электролитов, если ввести поправочный изотонический коэффициент Вант-Гоффа i, например:
π осм. = iCRT или Δ Tзам. = iKm.
Изотонический коэффициент связан со степенью диссоциации электролита (α ):
i = 1 + α (n - 1), где n - количество ионов, образующихся при диссоциации одной молекулы.
Электропроводность κ (" Каппа" ) раствора - величина, обратная его сопротивлению R, имеет размерность Ом-1. Для проводника постоянного сечения  , где ρ - удельное сопротивление; S - площадь сечения проводника; l - длина проводника; κ - удельная электропроводность.
, где ρ - удельное сопротивление; S - площадь сечения проводника; l - длина проводника; κ - удельная электропроводность.
Удельной электропроводностью κ (" каппа" ) раствора называется электропроводность слоя раствора длиной 1 см, заключенного между электродами площадью 1см2. Она выражается в Ом-1. см-1. В системе СИ удельная электропроводность измеряется в Ом-1. м-1.
Эквивалентной электропроводностью λ (" лямбда" ) называется электропроводность такого объема раствора, в котором содержится 1 моль химического эквивалента растворенного вещества; при условии, что электроды находятся на расстоянии 1 см друг от друга, она выражается в Ом-1. см2. моль-1.
|
|
|
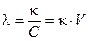 , где V = 1/C - разведение (или разбавление) раствора, т. е. объем, в котором содержится 1 моль эквивалентов растворенного вещества, а C – молярная концентрация химического эквивалента. В системе СИ эквивалентная электропроводность выражается в Ом-1. м2. моль-1.
, где V = 1/C - разведение (или разбавление) раствора, т. е. объем, в котором содержится 1 моль эквивалентов растворенного вещества, а C – молярная концентрация химического эквивалента. В системе СИ эквивалентная электропроводность выражается в Ом-1. м2. моль-1.
Эквивалентная электропроводность λ растворов электролитов возрастает с ростом разбавления раствора и при бесконечном разбавлении (т. е. при бесконечно малой концентрации) достигает предельного значения λ ∞. которое называется эквивалентной электропроводностью раствора при бесконечном разведении.
В растворах слабых электролитов λ и λ ∞ связаны со степенью диссоциации α электролита уравнением Аррениуса: 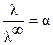 .
.
Электрохимические системы
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля): Zn | ZnSO4 || CuSO4 | Cu, где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || – солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления, поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu2+ + 2e = Cu Левый электрод: Zn2+ + 2e = Zn
Общая реакция: Cu2+ + Zn = Cu + Zn2+
Потенциал E электрода рассчитывается по формуле Нернста:  ,
,
где a(Ox) и a(Red) - активности окисленной и восстановленной форм вещества, участвующего в полуреакции; Eo – стандартный потенциал электрода (при a(Ox)=a(Red) =1); n – число электронов, участвующих в полуреакции; R – газовая постоянная; T - абсолютная температура; F - постоянная Фарадея.
|
|
|
При 25o C 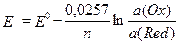 .
.
Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю.
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов: E = EП - EЛ.
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов: E0 = EП0 - EЛ0.
Для элемента Даниэля стандартная ЭДС равна
Eo = Eo (Cu2+/Cu) - Eo (Zn2+/Zn) = +0, 337 - (-0, 763) = +1, 100 В.
ЭДС элемента связана с Δ G протекающей в элементе реакции: Δ G = -nFE.
|
|
|


