 |
Пробой газообразных диэлектриков
|
|
|
|
Газообразныедиэлектрики широко применяются в газонаполненных и вакуумных конденсаторах. Воздух является хорошим изолятором, но только в слабых полях. Электрическая прочность газообразных диэлектриков не превышает 2–3 МВ/м. Процесс пробоя обусловлен лавинным умножением электронов под действием ударной ионизации и фотоионизации.
Число электронов, образующихся в течение 1 с в 1см3 воздуха под действием радиоактивности Земли или космических лучей, составляет от 10 до 20 [2]. Эти электроны являются начальными зарядами, приводящими к пробою в достаточно сильном поле.
При увеличении напряженности электрического поля Е электроны на длине свободного пробега λ приобретают энергию W=e λ E, достаточную для ионизации молекул газа: W≥ Wu (Wu - энергия ионизации, е - заряд электрона). Энергия ионизации – это наименьшая энергия, которую нужно затратить для отрыва одного электрона от нейтральной молекулы (атома). В результате при столкновении с молекулами и атомами «первичные» электроны порождают новые электроны. «Вторичные» электроны под действием поля, в свою очередь, вызывают ионизацию молекул газа. В результате этого процесса число электронов в газовом промежутке, лавинообразно нарастая, очень быстро увеличивается. Электроны распределяются в межэлектродном пространстве в виде компактного облачка, называемого электронной лавиной.
Известны два механизма пробоя газов: лавинный и лавинно-стримерный.
При лавинном механизме ударная ионизация электронами сопровождается вторичными процессами на катоде, в результате которых заряды в газовом промежутке восполняются. Пробой газа сопровождается образованием серии лавин, причем каждая вновь образующаяся лавина по сравнению с предыдущей содержит большее число электронов - происходит «раскачивание» электронных лавин. Лавинный пробой, как правило, развивается в течение относительно длительного времени (более 1 мкс) и не характерен для импульсных напряжений.
|
|
|
При лавинно-стримерном механизме на развитие пробоя существенно влияет совместное действие поля пространственного заряда лавины и фотоионизации в объеме газа.
В некоторых случаях электрон, ускоренный электрическим полем, может не ионизировать молекулу, а привести ее в возбужденное состояние: электрон, находящийся внутри молекулы, переходит из равновесного состояния с меньшей энергией в состояние с более высокой энергией (на более удаленную от ядра орбиту). Такая возбужденная молекула в следующий момент (за 10-7 с) отдает свою избыточную энергию в форме излучения - испускает фотон. Фотон поглощается какой-либо другой молекулой, которая при этом может ионизироваться. Такая внутренняя фотонная ионизация газа благодаря большой скорости распространения излучения приводит к быстрому развитию в разрядном промежутке каналов с повышенной концентрацией носителей заряда, которая достаточна для преобразования лавины в стример [3].
На рис. 2.13 представлена схема, поясняющая, почему рост электропроводящего канала — стримера — происходит быстрее, чем продвижение электронной лавины. На рис. 2.13 лавины условно показаны в виде заштрихованных конусов, а волнистыми линиями изображены пути фотонов. Внутри каждого конуса, представляющего собой развивающуюся лавину, газ ионизируется ударами электронов; вновь отщепленные электроны, разгоняемые полем, ионизируют встречаемые ими частицы газа, и, таким образом, лавинообразно нарастает число электронов, движущихся к аноду, и число положительных ионов, направляющихся к катоду.
Волнистые линии исходят из атомов, которые были возбуждены ударами электронов и вслед за тем испустили фотоны. Двигаясь со скоростью 3·108 м/с, фотоны обгоняют лавину и в каком-то месте, соответствующем концу волнистой линии, ионизируют частицу газа. Отщепленный здесь электрон, устремляясь к аноду, порождает новую лавину далеко впереди первой лавины. Таким образом, пока первая лавина вырастает, скажем, на длину малой стрелки АВ (рис. 2.13), намечающийся канал повышенной проводимости газа, т. е. стример, распространяется на длину большой стрелки CD.
|
|
|

Рис. 2.13. Схематическое изображение распространения стримера при пробое газа [3]
В следующей стадии отдельные лавины в отрицательном стримере, нагоняя друг другу, сливаются, образуя сплошной канал ионизированного газа.
Одновременно с ростом стримера, направленного от катода к аноду, начинается образование встречного лавинного потока положительно заряженных частиц, направленного к катоду. Положительный стример представляет собой канал газоразрядной плазмы. Поясним это подробнее. Электронные лавины оставляют на своем пути большое число вновь образованных положительных ионов, концентрация которых особенно велика там, где лавины получили свое наибольшее развитие, т. е. около анода. Если концентрация положительных ионов здесь достигает определенного значения (близкого к 1012 ионам в 1 см3), то, во-первых, обнаруживается интенсивная фотонная ионизация, во-вторых, электроны, освобождаемые частицами газа, поглотившими фотоны, притягиваются положительным пространственным зарядом в головную часть положительного стримера и, в-третьих, вследствие ионизации концентрация положительных ионов на пути стримера увеличивается, насыщение электронами пространства, заполненного положительными зарядами, превращает эту область в проводящую газоразрядную плазму. Под влиянием ударов положительных ионов на катоде образуется катодное пятно, излучающее электроны. В результате указанных процессов и возникает пробой газа. Обычно пробой газа совершается практически мгновенно: длительность подготовки пробоя газа при длине промежутка 1 см составляет 10-7–10-8 с. Чем больше напряжение, приложенное к газовому промежутку, тем быстрее может развиться пробой. Если длительность воздействия напряжения очень мала, то пробивное напряжение повышается.
|
|
|
Электрическая прочность газов уменьшается с ростом расстояния между электродами, имеет немонотонную зависимость от давления с минимумом, соответствующим давлению, близкому к атмосферному [2].
СЕГНЕТОЭЛЕКТРИКИ
Это вещества, обладающие спонтанной электрической поляризацией PS, направление которой может быть изменено приложением электрического поля Е определённой величины и определенного направления. Этот процесс, называемый переполяризацией, сопровождается диэлектрическим гистерезисом. Сегнетоэлектрики во многих отношениях являются электрическими аналогами ферромагнетиков. Однако по своей микроскопической природе сегнетоэлектрики и ферромагнетики совершенно различны. Свое название этот класс материалов получил от сегнетовой соли, впервые синтезированной в середине 19 века французским аптекарем Де ла Сенье и названной в честь него. Свойства сегнетовой соли были подробно исследованы советскими учеными И. В. Курчатовым и П. П. Кобейко. Теория сегнетоэлектриков была разработана в Советском Союзе В. Л. Гинзбургом, Г. И. Сканави, Г. А. Смоленским и др.
Наиболее распространенным сегнетоэлектриком является метатитанат бария BaTiO3, сегнетоэлектрические свойства которого открыли в 1944 г. Б. М. Вул и И. М. Гольдман.
 Между ионами О оказывается большое расстояние (ребро = 4,01 Å), в котором свободно помещается небольшой ион титана (
Между ионами О оказывается большое расстояние (ребро = 4,01 Å), в котором свободно помещается небольшой ион титана ( Å). При перемещении иона Ti не выполняется закон Гука
Å). При перемещении иона Ti не выполняется закон Гука  , то есть упругая сила растет не пропорционально смещению, а более резко. Колебания ионов под действием упругой силы, изменяющейся не пропорционально смещению, называются ангармоническими. Однако одного этого условия не достаточно для того, чтобы вещество обладало сегнетоэлектрическими свойствами. Есть много неплотно упакованных структур с ангармоническими колебаниями ионов, не являющихся сегнетоэлектриками.
, то есть упругая сила растет не пропорционально смещению, а более резко. Колебания ионов под действием упругой силы, изменяющейся не пропорционально смещению, называются ангармоническими. Однако одного этого условия не достаточно для того, чтобы вещество обладало сегнетоэлектрическими свойствами. Есть много неплотно упакованных структур с ангармоническими колебаниями ионов, не являющихся сегнетоэлектриками.
Можно назвать 3 основных фактора, определяющих возникновение сегнетоэлектричества:
|
|
|
1. Ангармоничность колебаний ионов в решетке, на которую влияет вид химических связей. Наиболее инициирующие – ковалентные.
2. Большое внутреннее электрическое поле, зависящее от строения кристалла.
3. Большая электронная и ионная поляризуемость.
Покажем возможность образования спонтанной поляризации в твердых телах.
В BaTiO3 образование спонтанной поляризации связано с большим значением электронной поляризуемости ионов О и Ti, а также большим значением внутреннего электрического поля.
Характерной особенностью сегнетоэлектриков является наличие спонтанной поляризации и её зависимость от температуры. Другой характерной особенностью является большая величина диэлектрической проницаемости в слабых электрических полях. Максимум 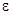 наблюдается в точках Кюри.
наблюдается в точках Кюри.
При  в переменных электрических полях у сегнетоэлектриков наблюдается диэлектрический гистерезис.
в переменных электрических полях у сегнетоэлектриков наблюдается диэлектрический гистерезис.
 – коэрцитивное поле. Если приложить это поле противоположно вектору спонтанной поляризации, то вектор спонтанной поляризации скачком изменит свое направление на обратное.
– коэрцитивное поле. Если приложить это поле противоположно вектору спонтанной поляризации, то вектор спонтанной поляризации скачком изменит свое направление на обратное.
Эти изменения связаны с доменной структурой. Домены – области, где величина и направление вектора спонтанной поляризации одинаковы. С энергетической точки зрения выгодно иметь многодоменную структуру.
Зависимость  от Е представлена на рис. 6.
от Е представлена на рис. 6.
Различают  начальную εн (при Е=0), максимальную εм, дифференциальную диэлектрическую проницаемость
начальную εн (при Е=0), максимальную εм, дифференциальную диэлектрическую проницаемость  .
.
На переменном напряжении измеряют реверсивную диэлектрическую проницаемость (рис. 7) Для этого к образцу прикладывают относительно большое постоянное напряжение и небольшое переменное, на котором измеряют емкость конденсатора с сегнетоэлектриком.
Рассмотрим свойства наиболее важного материала BaTiO3
При Т > 120oC – интенсивное тепловое движение препятствует возникновению спонтанной поляризации. При этом решетка кубическая с параметрами ячейки 4.01Å. При уменьшении до 120oC в точке Кюри – спонтанная поляризация – ионы Ti приближаются к одному из ионов кислорода. При этом решетка деформируется, вытягиваясь вдоль оси, по которой сместился ион Ti. Таким образом происходит фазовый переход решетки из кубической в тетрагональную. Тетрагональная ячейка слабо отличается от кубической. Отношение  . Вдоль оси c смещается ион Ti и в этом же направлении направлен вектор Р.
. Вдоль оси c смещается ион Ti и в этом же направлении направлен вектор Р.
При T=0 oC наблюдается второй фазовый переход из тетрагональной в орторомбическую. Связано с тем, что ионы Ti при T=0 oC смещаются одновременно к двум ионам кислорода вдоль диагонали грани элементарной ячейки, которая в этом направлении удлиняется. При 0 oC вектор поляризации, сохраняя величину, меняет направление.
|
|
|
 При 70oC происходит последний фазовый переход, и решетка имеет более низкую симметрию, моноклинную или триклинную. При этом ион Ti смещается одновременно к трем ионам кислорода вдоль объемной диагонали элементарной ячейки. Вектор поляризации опять меняет свое направление и фиксируется в направлении смещения иона Ti.
При 70oC происходит последний фазовый переход, и решетка имеет более низкую симметрию, моноклинную или триклинную. При этом ион Ti смещается одновременно к трем ионам кислорода вдоль объемной диагонали элементарной ячейки. Вектор поляризации опять меняет свое направление и фиксируется в направлении смещения иона Ti.
Для BaTiO3 при нормальной температуре характерна следующая зависимость ε от f.
 Связано с конечной величиной времени переполяризации.
Связано с конечной величиной времени переполяризации.
Применение сегнетоэлектриков.
Сегнетоэлектрическая керамика в отличие от других видов керамик имеет большую ε, сильно зависящую от Т. Сегнетокерамика на основе BaTiO3 используется при производстве конденсаторов с большим значением удельной емкости, пьезодатчиков и варикондов.
Сегнетоэлектрическая керамика, идущая на изготовление ВЧ конденсаторов делится на три группы:
1. Керамика со сглаженной зависимостью ε от Т.
2. Керамика с максимальной ε в определенном интервале Т.
3. Керамика с относительно маленькими диэлектрическими потерями и повышенной Епр.
 Существенной величиной для сегнетокерамики является коэффициент нелинейности.
Существенной величиной для сегнетокерамики является коэффициент нелинейности.

Вариконды – вещества с переменным значением емкости
Сегнетоконденсаторы – конденсаторы большой емкости.
Сегнетоэлектрики могут служить активными элементами диэлектрических усилителей. Здесь используется зависимость емкости от приложенного напряжения.
 Сегнетоэлектрики используются в резонансных усилителях, релейных устройствах, многофазных, быстродействующих усилителях, в диэлектрических модуляторах, стабилизаторах тока и напряжения и других схемах.
Сегнетоэлектрики используются в резонансных усилителях, релейных устройствах, многофазных, быстродействующих усилителях, в диэлектрических модуляторах, стабилизаторах тока и напряжения и других схемах.
МЕТАЛЛЫ И СПЛАВЫ
3.1. Классификация и свойства металлов
и сплавов
К металлам относятся вещества, обладающие высокими теплопроводностью и электрической проводимостью, ковкостью, блеском и другими характерными свойствами, которые обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Единственными объективными критериями, позволяющими отнести материал к металлам, считаются наличие электропроводности при Т = 0 К и положительный температурный коэффициент удельного сопротивления. Указанными выше свойствами обладают свыше 80 простых веществ (элементов) и множество металлических сплавов.
Все металлы и сплавы делят на черные (к ним относят железо и сплавы на его основе; на их долю приходится около 95 % производимой в мире металлопродукции) и цветные или, точнее, нежелезные (все остальные металлы и сплавы). По физическим и химическим свойствам и характеру залегания в земной коре нежелезные металлы делят на следующие группы: легкие – алюминий, магний, титан, бериллий, литий, натрий, калий, стронций, барий и др.; тяжелые – медь, никель, кобальт, свинец, олово, цинк, кадмий, сурьма, висмут, ртуть и др.; тугоплавкие – вольфрам, молибден, ниобий, тантал, ванадий, хром, цирконий и др.; благородные – золото, серебро, платина и платиноиды (рутений, родий, палладий, осмий, иридий); рассеянные – галлий, индий, таллий; редкоземельные – скандий, иттрий, лантан и все лантаноиды; радиоактивные – технеций, франций, радий, полоний, актиний, торий, уран и трансурановые элементы.
Приведенная классификация условна: многие металлы могут быть отнесены одновременно к разным группам. Например, легкий металл титан является также тугоплавким; тугоплавкий металл рений – типичный рассеянный элемент и т.д.
Металлы играют огромную роль в современной технике. Обычно металлы применяют не в чистом виде, а в виде сплавов, количество которых превышает 10 тысяч.
Металлы получают из руд, а также путем вторичной переработки материалов. Рудами называют горные породы, которые технически возможно и экономически целесообразно перерабатывать для извлечения содержащихся в них металлов. К основным процессам металлургического процесса относятся: обработка руд с целью их подготовки к извлечению металлов (дробление, обогащение, окускование и пр.); извлечение металлов из руд и других материалов; очистка металлов от нежелательных примесей; производство металлов и сплавов; термическая, химико-термическая и термомеханическая обработка; формообразование давлением и литьем; покрытие в декоративных или защитных целях поверхности изделий из металла слоями другого металла.
К основным свойствам металлов и сплавов относятся физические (в том числе механические), химические, технологические и функциональные. К физическим свойствам относятся: температура плавления, цвет, плотность, магнитная восприимчивость, электропроводность, теплоемкость и др. Особую группу составляют механические свойства: прочность, пластичность, твердость, ударная вязкость и др.
Химические свойства металлов определяются способностью их атомов легко отдавать валентные электроны и переходить в состояние положительно заряженных ионов. Указанное определяет особенности химического взаимодействия металлов и сплавов с агрессивными средами.
К технологическим свойствам металлов и сплавов относится их способность к формоизменению (ковкость, свариваемость и т.д.). Важное значение имеет жидкотекучесть – свойство расплавленного металла заполнять и точно воспроизводить литейную форму.
Функциональные или эксплуатационные свойства включают в себя хладостойкость, жаропрочность, жаростойкость, антифрикционность и другие характеристики материалов, определяемые условиями их работы.
ОСНОВНЫЕ ТИПЫ СПЛАВОВ
Чистые металлы в большинстве случаев не обеспечивают необходимого комплекса механических, технологических и функциональных свойств и поэтому применяются редко. В большинстве случаев в технике используют сплавы.
Металлическим сплавом называют материал, состоящий из двух или более компонентов и обладающий свойствами, характерными для металлов. Сплавы создаются в результате расплавления, спекания исходных компонентов и другими методами [7]. Необходимым процессом получения сплава является диффузия элементов в твердом, жидком или газообразном состоянии. Диффузия осуществляется путем взаимного проникновения частиц каждого из компонентов сплава с образованием новых однородных тел, называемых фазами.
Для описания свойств сплавов в металловедении используют понятия: система, фаза, компонент.
Системой называют совокупность фаз, находящихся в равновесии при определенных внешних условиях (температуре, давлении).
Фазой называют однородную по химическому составу, кристаллическому строению и свойствам часть системы, отделенную от ее других частей поверхностью раздела. Однофазной системой являются, например, однородная жидкость, твердый чистый металл; двухфазной – механическая смесь двух видов кристаллических веществ.
Компонентами называют вещества, образующие систему. Компонентами могут быть элементы (металлы и неметаллы), а также химические соединения. По числу компонентов различают двойные, тройные и многокомпонентные сплавы. Компонент сплавов может быть основным, легирующим или случайным.
Сплавы, находящиеся в твердом состоянии, делят по составу на 3 группы: твердый раствор, химическое соединение, механическая смесь компонентов.
Твердый раствор. В жидком состоянии большинство металлических сплавов представляет собой однородные жидкости, т.е. жидкие растворы. При переходе в твердое состояние во многих таких сплавах однородность, а следовательно и растворимость, сохраняется. Твердый раствор, как и металл, имеет одну кристаллическую решетку, соответствующую типу кристаллической решетки основного компонента сплава (растворителя). Различие состоит в том, что в кристаллической решетке металла размещаются атомы одного элемента, а в твердом растворе – атомы различных элементов, образующих этот твердый раствор.
По характеру размещения атомов в кристаллической решетке различают твердые растворы замещения (рис. 3.3,а) и твердые растворы внедрения (рис. 3.3,б).


Рис. 3.3. Расположение атомов в твердых растворах [1]: а – замещения; б – внедрения; ™ – атом компонента-растворителя;? – атом растворимого компонента
В твердых растворах замещения, состоящих из компонентов А и В, атомы растворимого компонента В замещают отдельные атомы основного компонента А – растворителя в кристаллической решетке. В этом случае при несовпадении размеров атомов размер элементарной ячейки может изменяться. Растворимость в твердом состоянии может быть неограниченной или ограниченной. Неограниченная растворимость обеспечивает замещение в кристаллической решетке любого числа атомов компонента А атомами компонента В.
Неограниченная растворимость возможна при следующих условиях:
1) наличие у компонентов кристаллических решеток (элементарных ячеек) одного типа;
2) незначительное отличие размеров атомов компонентов (не более чем на 8 %);
3) достаточно близкое соответствие строения валентных оболочек атомов компонентов (тип химической связи).
Примерами сплавов с неограниченной растворимостью компонентов являются сплавы Cu–Ni, Fe–Ni, Fe–Cr и др.
Если компоненты сплава не полностью удовлетворяют указанным выше условиям, образуются твердые растворы замещения с ограниченной растворимостью компонентов.
При этом чем больше разница в размерах атомов компонентов, тем меньше растворимость в твердом состоянии. С изменением температуры ограниченная растворимость в твердом состоянии обычно меняется. Примерами систем с ограниченной растворимостью компонентов являются Al–Cu, Mg–Al и др.
В твердом растворе внедрения атомы растворимого компонента внедряются в междоузлия кристаллической решетки основного компонента (рис. 3.3,б). Такие твердые растворы обычно образуются, когда атомы растворимого компонента имеют небольшие размеры по сравнению с атомами растворителя. Чаще всего это имеет место, когда в металле растворяются неметаллические элементы. Примером твердого раствора внедрения является сплав Fe–C.
Химическое соединение. Элементы, образующие химические соединения, обычно резко отличаются по размерам атомов, строению электронных оболочек и параметрам кристаллических решеток. К образованию химических соединений склонны элементы, далеко расположенные друг от друга в периодической таблице Д.И. Менделеева.
В отличие от обычных химических соединений многие металлические соединения имеют переменный состав, который может изменяться в широких пределах. Получение химического соединения AmBn с образованием однородного кристаллического вещества возможно только при строго определенных весовых соотношениях компонентов. При этом образуется кристаллическая решетка, не похожая на решетки сплавляемых компонентов. Примером может служить сплав Cu–Mg при содержании 17 % Mg. Свойства сплава – химического соединения резко отличаются от свойств элементов, образующих его.
Сплавы – химические соединения не всегда встречаются в чистом виде. Например, при избытке растворимого компонента возможно образование химического соединения в комбинации с твердым раствором.
Механическая смесь. Образование механических смесей происходит, когда элементы обладают ограниченной растворимостью, а также при наличии химического соединения. Механические смеси могут состоять из кристаллов чистых компонентов, твердых растворов и химических соединений. При образовании механической смеси кристаллические решетки отдельных фаз не меняются. Механические смеси обычно образуют металлы, отличающиеся друг от друга размерами атомов и температурой плавления. Примером сплава, образующего механическую смесь, является система Ag–Pb.
Приведенные выше положения указывают в общем виде на особенности взаимодействия элементов при образовании сплавов и на их возможную структуру. Однако при образовании и термообработке сплавов на основе конкретных компонентов возникают особенности, которые в металловедении изучаются экспериментально. Например, для установления режимов термической обработки сплавов с целью придания им необходимых свойств необходимо знать температуры начала и окончания процессов плавления, перехода в твердое состояние, особенности структурных превращений в критических точках. Построение кривых охлаждения (нагревания) на основе экспериментальных данных называется термическим анализом. Полученные экспериментальные данные систематизируют, обобщают и отображают в виде особых диаграмм – диаграмм состояния сплавов.
ОСНОВНЫЕ СВОЙСТВА ЖЕЛЕЗА
Чистое железо – металл серебристо-белого цвета, весьма пластичный. Железо образует несколько окислов: FeO, Fe2O3, Fe3O4. Температура плавления Тпл=1539 °С, кипения – Ткип=2450 °С. Свойства железа в значительной степени зависят от содержания углерода, в меньшей – от других компонентов, концентрация которых ниже (Si, Mn, P, S и др.).
Для железа характерно явление полиморфизма (аллотропии), при котором твердые вещества могут изменять тип кристаллической решетки и свойства под воздействием внешних факторов (температура, давление и т.д.) Железо имеет 4 полиморфные модификации: a-, b-, g- и d-Fe. Кристаллическая решетка a-, b- и d-Fe – ОЦК с разными межатомными расстояниями, g-Fe – ГЦК. Модификации a- и g-Fe способны образовывать твердые растворы с углеродом. Другими примерами веществ, обладающих аллотропными модификациями структуры и свойств, являются: углерод (алмаз и графит); двуокись кремния (a- и b-кварц, тридимит, кристобалит, стишовит, коэсит); серое и белое олово.
Полиморфные превращения являются обратимыми, в процессе выделяется скрытая теплота кристаллизации (если превращение идет при охлаждении). На кривой охлаждения появляются критические точки и горизонтальные участки, соответствующие процессам перекристаллизации.
На рис. 3.11 приведена кривая охлаждения железа из расплавленного состояния, на которой горизонтальными участками отделены температурные интервалы существования различных модификаций железа.

Рис. 3.11. Кривая охлаждения железа
При переходе b-Fe в a-Fe тип кристаллической решетки сохраняется, но меняются физические свойства: железо из парамагнитного состояния переходит в ферромагнитное, т.е. при температуре ниже 768 °С становятся возможными спонтанная намагниченность материала и его доменная структура.
К железоуглеродистым сплавам относят стали и чугуны. Основными элементами, от которых зависят структура и свойства сталей и чугунов, являются железо и углерод.
Железо с углеродом образует твердые растворы внедрения и химическое соединение; a–железо растворяет очень мало углерода (до 0,02 % при 727 °С). Твердый раствор углерода и других элементов в a-железе называется ферритом. Феррит имеет низкую твердость и прочность: НВ 80; sB=250 МПа (25 кгс/мм2) и высокую пластичность (Q=50 %). g-железо растворяет значительно большее количество углерода – до 2,14 % при 1147 °С. Твердый раствор углерода и других элементов в g-железе называется аустенитом. В железоуглеродистых сплавах он может существовать только при высоких температурах. Аустенит пластичен, твердость его НВ 160–200, Q=40¸50 %.
Железо с углеродом также образует химическое соединение Fe3C, называемое цементитом или карбидом железа. В цементите содержится 6,67 % С; он имеет высокую твердость (~НВ 800), но чрезвычайно низкую, практически нулевую пластичность.
|
|
|


