 |
Электрофореза в агарозном геле
|
|
|
|
Электрофорез как метод фракционирования заряженных молекул (ДНК, РНК, белков) в электрическом поле был представленнами ранее как аналитический метод, спользующийся для визуализации нативной ДНК и ее фрагментов различного происхождения (геномная ДНК, ДНК плазмид, продукты рестрикции, ПЦР- продукты). Во всех указанных случаях нужно было увидеть результат производимых манипуляций с ДНК, охарактеризованной поэлектрофоретической подвижности. Однако имеется и другая область приложения метода электрофореза — очистка определеннойфракции полинуклеотидов, или препаративный электрофорез.
Принципиально препаративный электрофорез не отличается
от аналитического, основное требование к нему — доступность
носителя (геля) для последующего извлечения из него целевого
полинуклеотида. Для наибольшей продуктивности электрофореза
используемая пластина агарозного или полиакриламидного геля
должна быть относительно крупного размера и по своим механическим свойствам удобна для разрезания, измельчения или растворения.
Полиакриламидный гель как носитель для электрофореза нуклеиновых кислот по аналитическим характеристикам значительнопревосходит агарозный, обладая большим разрешением (до одного нуклеотида, у агарозного — 10 и более нуклеотидов) и широким
диапазоном плотностей, используемых для самых разных целей.Однако полиакриламид — химически инертный материал и почтине растворяется ни в одном из известных растворителей. Растворить ПААГ можно в концентрированном пероксиде водорода, однако
при этом неизбежно разрушение ДНК, РНК и белков. Этот прием применим только для очистки стеклянных трубок или пластин от примесей геля; остающегося на их стенках послеокончанияработы.
Извлечение (элюция) ДНК путем простой диффузии из крупного
блока полиакриламидного геля — длительный и малоэффективный процесс, хотя его можно несколько усовершенствовать, например при подключении электрического тока (электродиффузия). Тем не менее полностью извлечь из ПААГ фракционированный целевой фрагмент можно только после механического разрушения геля, а это недопустимо в случае разделения длинных молекул ДНК, так как они также могут быть разрушены.
|
|
|
Фракционирование нуклеиновых кислот методом электрофореза в ПААГ все же применяют:
для разделения и очистки (препаративного разделения) коротких олигонуклеотидов, например химически синтезированных
праймеров и зондов для ПЦР с детекцией продукта в реальном
времени (геа1-time РСR) или гибридизации;для непрерывного фракционирования (в отличие от стационарного), осуществляемого подобно хроматографии, однако в
этом случае продукты детектируют не на выходе, а в толще носителя на определенном участке гелевого блока по ходу электрофореза. При этом гелевая камера чаще всего имеет вид капилляра с отводным каналом, расположенным напротив окошка детектора,
и, как только истечет определенное время электрофореза («время
удержания») для целевого фрагмента в геле, направление движения фрагмента меняют на боковое путем переключения электрических контактов (рис. 8).
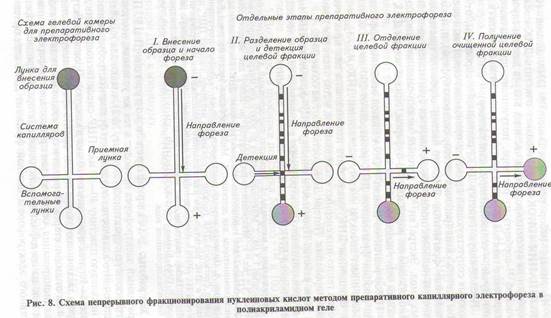
Агарозный гель более удобен в качестве носителя для препаративного электрофореза, так как для проведения этого вида электрофореза не требуется специального оборудования (может бытьиспользована камера для горизонтального аналитического электрофореза). Для окрашивания нуклеиновых кислот чаще всего используют интеркалирующие красители, такие как бромистый
эдидий или более чувствительный SYBR Green, которые флуоресцируют в УФ-свете. Наблюдать за ходом электрофореза можно визуально, периодически помещая гель на светофильтр трансиллюминатора и фиксируя таким образом момент, когда целевой фрагмент в достаточной степени отделится от остальных
фракций. Как только это произойдет, участок агарозного геля, содержащий целевой фрагмент, необходимо вырезать из гелевой
пластины. Для элюции целевого фрагмента ДНК вырезанный участок агарозного геля можно расплавить (нуклеиновые кислоты
при этом обычно не разрушаются, кроме того, можно использовать и сорта легкоплавкой агарозы) или растворить, например, в
концентрированном растворе гуанидинтиоцианата, а затем извлечь целевой фрагмент из раствора с помощью одного из методов
выделения ДНК.
|
|
|
Чтобы уменьшить потери на этом этапе, для связывания нуклеиновых кислот используют сорбент на основе оксида кремния
(SiO2) или в виде водной суспензии (так называемое стеклянное
молоко или glass milk), или нанесенный на поверхность полупроницаемой мембраны. Электрофорез в агарозном геле непригоден
для разделения коротких олигонуклеотидов, а элюция с использованием сорбентов в этом случае малоэффективна и приводит к
значительным потерям.
Таким образом, большинство задач, связанных с очисткой нуклеиновых кислот, можно решить методом препаративного электрофореза, подобрав соответствующие условия, а указанные особенности наиболее доступных носителей дополняют друг друга и расширяют возможности эксперимента.
Препаративный электрофорез очень часто используется для
очистки нуклеиновых кислот, особенно ДНК, поэтому для элюции ДНК из агарозного геля теперь производится целый ряд
коммерческих наборов реагентов. Использование таких наборов
обеспечивает минимальные потери и высокое качество элюированной нуклеиновой кислоты с минимальными затратами времени.
Например, набор реагентов Diatom™ DNA Elution (ООО
«КОМПАНИЯ «БИОКОМ») позволяет очистить ДНК после ее
сорбции на суспендированных частицах SiO2 (в данном случае —
NucleoS™-сорбент) из раствора, полученного при растворении
агарозного геля в 3,5—4,0 М растворе гуанидинтиоцианата (в данном случае — солюбилизирующий раствор).
Последующую очистку ДНК, связанной с сорбентом, от возможных сопутствующих примесей производят спиртовым раствором ацетата калия (рабочий раствор солевого буфера),и,наконец,отделение фрагментов ДНК от частиц сорбента (растворение,
элюция) наиболее полно обеспечивается суспензией ионообменных смол. ЭкстраГен™Е,который можно заменить стерильной
деионизованной водой или ТЕ-буфером, однако потери ДНК при
элюции будут выше на 15—20 %.
|
|
|
Набор реагентов Diatom™ DNA Elution особенно эффективен
для элюции фрагментов ДНК размером от 200 до 20 000 п.н. и
обеспечивает высокую чистоту выделенной ДНК (А260/A280=1,6
2). Очищенная ДНК может быть использована для практически
любых генно-инженерных исследований, в том числе для прямого
секвенирования. Потери ДНК составляют не более 20 %.
Цель работы. Произвести очистку ПЦР-фрагмента ДНК методом препаративного электрофореза в агарозном геле с последующей элюцией ДНК на суспендированном сорбенте.
Оборудование и материалы. 1. Термостат твердотельный для микропробирок
вместимостью 1,5 мл. 2. Микроцентрифуга до 5000 g для микропробирок вместимостью 1,5 мл. 3. Микроцентрифуга-вортекс до 2000g для микропробирок.
4. Оборудование для горизонтального электрофореза ДНК в агарозном геле с
трансиллюминатором для детекции. 5. Микропробирки вместимостью 1,5 мл с
крышками. 6. Цилиндр мерный вместимостью 250 мл. 7. Раствор неочищенного
целевого фрагмента ДНК (можно использовать, например, продукт ПЦР, полученный с ДНК растительного или животного происхождения и специфичными
для гена 18S рРНК олигонуклеотидньши праймерами — см. практическую работу
№ 7). 8. Набор реагентов для элюции ДНК из агарозного геля (например,
Diatom™, DNA Elution ООО «КОМПАНИЯ «БИОКОМ»). 9. 96%-ный этанол.
10. Бидистиллированная вода.
Ход работы. Электрофорез продуктов ПЦР. Препаративный электрофорез проводят в тех же условиях, что и аналитический (см. практическую работу № 2), только для получения достаточного количества очищенного фрагмента требуется нанести на гелевую пластину 40—50 мкл ПЦР-смеси (использовать для
этого 4—5 лунок и вносить по 10 мкл в каждую). Процесс электрофореза заканчивают, когда пробег фронта краски-лидера составит
3—4 см от линии старта. Периодически можно наблюдать за ходом
фракционирования, останавливая процесс электрофореза и помещая гель на светофильтр трансиллюминатора. В процессе препаративного электрофореза целевой фрагмент ДНК отделяется от. неиспользованных нуклеозидтрифосфатов, балластных белков,
ДНК-матрицы (остается вблизи старта) и оставшихся праймеров
(располагаются вблизи фронта пробега, обозначенного краскойлидером).
|
|
|
Элюция целевого фрагмента ДНК. 1. Помещают
гелевую пластину на светофильтр трансиллюминатора, включают
УФ-облучение и, наблюдая через защитное стекло (или очки), отмечают расположение целевого фрагмента.
2.Вырезают участки геля, содержащие целевой фрагмент, так,
чтобы не захватывать лишний гель и не оставлять ДНК в гелевой
пластине, аккуратно помещают вырезанные участки в две микропробирки вместимостью 1,5 мл.
3.Далее, следуя инструкции к набору реагентов Diatom™ DNA
ЕLution, готовят рабочий раствор солевого буфера. Для этого содержимое флакона с солевым буфером из комплекта набора переносят в мерный цилиндр, доводят бидистиллированной водой до50 мл, а затем 96%-ным этанолом до 200 мл и перемешивают. Готовый рабочий раствор солевого буфера следует хранить в герметично закрытой посуде при температуре 2 — 8 °С.
4.К фрагменту геля объемом около 100—200 мкл (по маркировке микропробирки) добавляют 500 мкл солюбилизирующего реагента из комплекта набора. Термостатируют пробирку при 65°С в течение 3—5 мин, при этом гель должен полностью раствориться.
5.Добавляют в пробирки по 25 мкл NucleoS+™ и 100 мкл связывающего реагента из комплекта набора. Количество добавляемого сорбента можно варьировать в зависимости от требуемого количества элюируемой ДНК. Для элюции 10 мкг ДНК следует добавить 20 мкл NucleoS+™.
6.Содержимое пробирок суспендируют при переворачивании,
выдерживают при комнатной температуре 5—7 мин, переворачивая пробирки несколько раз каждые 1—2 мин. Постоянное переворачивание пробирки на ротаторе способствует максимальной сорбции ДНК с сорбентом Мис1ео§+™ и, следовательно, сводит/V потери ДНК к минимуму.
7.Центрифугируют пробирки 10 с при 5000g, супернатант полностью удаляют.
8.Добавляют к осадку 1 мл рабочего раствора солевого буфера.
Содержимое пробирки встряхивают на вортексе 5—10 с до гомогенного состояния.
Внимание! Если суспендирование осадка затруднено из-за сильного
слипания частиц сорбента (при высоком содержании ДНК), рекомендуется осторожное пипетирование осадка с последующим встряхиванием на вортексе до гомогенного состояния. '-»
9.Центрифугируют пробирки 10 с при 5000g, супернатант полностью удаляют, Повторяют пп. 7—9.
|
|
|
10.Подсушивают осадок в пробирке 4—5 мин, поместив ее в
термостат на 65 °С и открыв крышку.
11.Добавляют к осадку 100 мкл ЭкстраГенаЕ™.
Внимание! ЭкстраГен Е™ следует предварительно встряхнуть и
затем отбирать от общего объема при постоянном перемешивании
(пипетировании).
12.Суспендируют содержимое пробирки на вортексе 5—10 с до
получения гомогенной суспензии, термостатируют 4—5 мин при
65°С. На этом этапе работы происходит элюция: ДНК, связанная
с сорбентом, переходит в раствор. Еще раз суспендируют содержимое пробирки на вортексе и центрифугируют 2 мин при
10 000 g.
13.Супернатант (раствор очищенной ДНК) отбирают и переносят в чистую микропробирку.
Хранят образец очищенной ДНК при —18°С, если не предполагается частое размораживание, в противном случае — при 2—8 °С.
Контрольные вопросы. 1. Как происходит разделение фрагментов ДНК в электрическом поле? На каком принципе основан электрофорез нуклеиновых кислот?
2. Каково устройство камеры для горизонтального электрофореза нуклеиновых
кислот? Как следует подключать электроды к источнику постоянного напряжения? 3. Почему агарозный гель малопригоден для фракционирования фрагментов
ДНК размером менее 50 п.н.? 4. Каковы основные этапы процесса очистки ДНК
представленным методом? В чем сущность каждого этапа?
Задания.1. Очистить ПЦР-фрагмент ДНК гена 18S рРНК.
2. Определить концентрацию ДНК в очищенном фрагменте.
Практическая работа № 9
РЕАКЦИЯ ОБРАТНОЙ ТРАНСКРИПЦИИ
Обратная транскрипция (ОТ) — процесс ферментативного синтеза ДНК на РНК-матрице, который катализирует фермент обратная транскриптаза (ревертаза, РНК-зависимая ДНК-полимераза,КФ 2.7.7.49). Данный фермент является важнейшим фактором репродукции всех ретровирусов и наиболее хорошо изучен у онковирусов. После открытия этого фермента X. Темином и независимо от него Д. Балтимором в 1970 г. стало понятно, каким способом РНК-содержащие вирусы встраиваются в геном хозяина. Таким же способом размножаются ретротранспозоны — мобильные
элементы генома эукариот, постоянно претерпевающие в своем «жизненном» цикле репродукцию путем транскрипции и интеграцию посредством обратной транскрипции.
Обратная транскриптаза всех ретроэлементов обладает тремя
активностями:
1)РНК-зависимая ДНК-полимеразная (обеспечивает синтез
первой цепи ДНК — комплементарной ДНК (кДНК) — на РНК-матрице, формируя гибридную РНК—ДНК молекулу);
2)ДНК-зависимая ДНК-полимеразная (обеспечивает синтез второй цепи ДНК на ДНК-матрице);
3) РНКазная (гидролизует исходную РНК подобно РНКазе Н).
Этот процесс in vitro инициирует комплекс белков, прикрепленных к 3'-концу геномной РНК, откуда и начинается синтез кДНК; in vitro инициировать синтез кДНК можно с помощью олигонуклеотидных праймеров — коротких фрагментов одноцепочечной ДНК, комплементарных:
1)известной последовательности какой-то определенной РНК;
2)поли-А-«хвосту»(олиго(А)-последовательности на 3'-конце)зрелых информационных (матричных) РНК эукариот (мРНК);
3)сразу нескольким случайным последовательностям нуклеотидов в виде смеси (как правило, не менее 10 шестичленных олигонуклеотидов).
Принципиальное различие этих способов инициации состоит в
том, что в первом случае реакции обратной транскрипции подвергают только определенную, охарактеризованную секвенированием РНК (или некоторое количество гомологичныхмолекул), во втором — только мРНК, но не рРНК или тРНК (а также не РНКпрокариот) и в третьем — все разновидности РНК. Но в любом
случае инициации in virto синтез кДНК прерывается, как только
обратная транскриптаза достигнет 5'-конца РНК-матрицы. Синтез второй цепи ДНК (анти-кДНК) осуществим в ходе той же реакции с помощью обратного праймера, комплементарного определенной последовательности кДНК (для варианта 1), случайных праймеров (для варианта 3) или чаще всего уже с помощью последующей ПЦР (для варианта 2 и любого другого), что гораздо удобнее и эффективнее реакции ОТ. Какойпроцесспроисходит тугуо на 5'-конце РНК-матрицы, до конца неясно, но очевидно,чтовозможно два пути: либо далее следуют повторные инициации посредством белков, либо синтез ДНК продолжается уже на кДНК-
матрице, не прерываясь и не останавливаясь до тех пор, пока не
образуется двухцепочечная кольцевая (синтезированная «сама на
себе») молекула ДНК — весьма устойчивая форма для интеграции
в геном (в силу ее недоступности для экзонуклеаз).
В качестве инструмента для реакции ОТ in vitro применяют несколько обратных транскриптаз, препараты которых производят в
промышленных масштабах. Чаще других используют М-МLV(или М-МuVL) — обратную транскриптазу вируса лейкоза крыс и
АМV — обратную транскриптазу вируса саркомы птиц. Реже других употребляют обратную транскриптазу теломеров (ДНК-теломераза) эукариот. Этот фермент присутствует у большинства эукариот, в его функции входит восстановление теломерных участков ДНК хромосом, частично утрачиваемых после каждого акта репликации генома, что также происходит путем матричного синтеза
ДНК на РНК. Особенностями этого совершенно уникального
фермента, отличающими его от других обратных транскриптаз,
являются постоянная РНК-матрица, неразрывно связанная с самим ферментом, и, как следствие, отсутствие РНКазной активности.
Реакцию обратной транскрипции широко применяют прежде
всего в создании кДНК-библиотек — препаратов кДНК, полученных после обработки обратной транскриптазой тотальной РНК,
выделенной из определенного организма, органа или ткани на определенной стадии развития, с олиго(дТ)-праймерами (комплементарны поли (А)-хвосту мРНК). В результате получаются одноцепочечные ДНК-копии всех матричных РНК, по качественному составу и количеству которых можно судить об уровне экспрессии
каких-либо генов. В то же время размер и первичная структура
кДНК в сравнении с соответствующей последовательностью в геномной ДНК позволяют выявить в ней некодирующие последовательности (интроны).
Другая область применения метода обратной транскрипции
(прикладная, но очень важная) — диагностика заболеваний, вызываемых РНК-содержащими вирусами (например, вирус иммунодефицита человека, вирус гепатита С, поражающий животных и человека), а также онковирусами. Последнее направление в наступившем XXI в. развивается особенно активно, что обещает если не
полную победу, то, по крайней мере, профилактику и надежный
контроль над этими опасными заболеваниями.
Цель работы. Ознакомиться с методом реакции обратной
транскрипции.
Оборудование и материалы. 1. Термостат твердотельный для микропробирок
вместимостью 0,5—0,6 мл. 2. Микроцентрифуга-вортекс до 2000 g для микропробирок вместимостью 0,5—0,6 мл. 3. Лед. 4. Раствор РНК (препарат РНК, полученный при выделении тотальной РНК — см. практическую работу№4). 5.Обратная транскриптаза (например, М-МuLV Reverse Transcriptase производства Рготеga
Со, США, или другая): 200 ед/мкл. 6. 10х ОТ буфер (как правило, поставляется в
комплекте с препаратом соответствующей обратной транскриптазы): 500 мМ
трис-НС1 рН 8,3, 750 мМ КС1, 30 мМ МgС12, 100 мМ дитиотреитол. 7. Смесь
дНТФ: 2,5 мМ каждого в стерильной деионизованной воде. 8. Смесь праймеров:
суммарно 40 мкМ, для вовлечения в реакцию всей выделенной РНК используют
смесь случайных нуклеотидных гексамеров (для последующей ПЦР, полученной
кДНК с праймерами на ген 185 рРНК, необходимо использовать именно эту смесь), для ОТ с использованием в качестве матрицы только мРНК — олиго(дТ)[5
праймер (длиной 15 нуклеотидов). 9. Ингибитор РНКазы (например, RiboLock™
Ribonuclease Inhibitor, «Рromеgа Со» или другой): 10 ед/мкл. 10. ДНКаза: 10 ед/мкл.
11. 10х буфер для ДНКазы (как правило, поставляется в комплекте с препаратом
соответствующей ДНКазы). 12. Стерильная деионизованная вода. 13. Вазелиновое
масло.
Ход работы. Внимание! Если концентрации готовых буферных растворов и ферментов в используемых препаратах отличаются отуказанных в разделе «Материалы и оборудование», необходимо изменить соответствующие объемы в приведенной ниже инструкции.
Подготовка препарата РНК (разведение и очистка
от примеси ДНК). 1. Измеряют оптическую плотность препарата
РНК, полученного при выделении тотальной РНК (см. практическую работу № 4) при 260 нм против растворителя (ΔА260), для
получения величин в пределах 0,05—0,5 ед. препарат требуется предварительно разбавить примерно в 50—100 раз.
2. Вычисляют концентрацию РНК, мкг/мкл, в препарате по
СРНК = ΔА260 х 40 х разбавление/1000.
3.Готовят 30—50мкл раствора РНК концентрацией 0,1 —
0,4 мкг/мкл (на стерильной деионизованной воде).
4.Отбирают 17 мкл разбавленного раствора РНК в стерильную
микропробирку вместимостью 0,5—0,6 мл и добавляют последовательно 2 мкл 10х буфера для ДНКазы и 1 мкл препарата ДНКазы
(10 ед/мкл), осторожно перемешивают, добавляют две капли вазе-
линового масла и центрифугируют для сброса капель на дно про-
бирки.
5.Помещают закрытую пробирку в термостат, инкубируют
15 мин при 37 "С, а затем 5 мин при 95 "С, пробирку охлаждают на
воздухе до комнатной температуры.
Реакция обратной транскрипции. 1. В стерильную микропробирку вместимостью 0,5—0,6 мл вносят 5 мкл свежеприготовленного раствора РНК (без примеси ДНК), 2 мкл смеси праймеров, 4 мкл смеси дНТФ и 4 мкл стерильной деионизованной воды.
2.Смесь инкубируют 5 мин при 70 °С, затем охлаждают во льду.
3.Добавляют 2 мкл Юх ОТ буфера, 1 мкл ингибитора РНКаз
(10 ед/мкл) и 2 мкл стерильной деионизованной воды.
4.Смесь инкубируют 5 мин при комнатной температуре (при
использовании смеси случайных гексамеров) или 5 мин при 37 "С
(при использовании олиго(дТ)15).
5.Добавляют 1 мкл обратной транскриптазы (200 ед/мкл), осторожно перемешивают, инкубируют 10 мин при комнатной температуре и еще 60 мин при 37 °С (при использовании смеси случайных гексамеров и олиго(дТ)15)
6. Останавливают реакцию нагреваниемдо70°С,выдерживаютпри этой температуре 10 мин иохлаждаютвольду. Полученнуюсмесь, содержащую кДНК, можно использовать немедленно или хранить при —18 °С.
Проведение ПЦР с кДНК. Постановку ПЦР с кДНК
проводят по инструкции, представленной в практической работе
№ 8. Для проверки качества полученного препарата кДНК (отсутствие геномной ДНК и веществ,ингибирующихПЦР;наличие достаточного количества целевой кДНК) рекомендуется использовать для амплификации праймеры для обнаружения гена 18S
рРНК, а также перечисленные далее образцы:
1)препарат РНК, разбавленный для проведения реакции обратной транскрипции (см. Подготовку препарата РНК, п. 3);
2)препарат РНК, очищенный от ДНК (см. Подготовку препарата РНК, п. 5);
3)препарат кДНК (см. Реакцию обратной транскрипции, п. 6);
4)отрицательный контроль (стерильная деионизованная вода);
5)положительный контроль с любым препаратом ДНК, выделенным из эукариот (см. практические работы № 3, 4).
Детекцию продуктов ПЦР проводят методом электрофореза в
агарозном геле (см. практическую работу № 2).
Контрольные вопросы. 1.Зачем требуется синтезировать кДНК для проведения
ПЦР с РНК? 2.Чем отличается постановка реакции обратной транскрипции для
мРНК и для тотальной РНК? 3. Как получить кДНК только с определенной РНК?
4. Можно ли получить кДНК с использованием олиго(дТ)|5 на транскриптах про-
кариот? Ответ поясните. 5. Какие этапы следует произвести для молекулярной
диагностики заболевания СПИДом?
Задания. 1. Интерпретировать полученные после ОТ—ПЦР результаты: объяснить наличие или отсутствие продуктов ПЦР на
электрофореграмме для каждого варианта постановки ПЦР.
2. Интерпретировать результаты, представленные на электрофореграмме (рис. 9).
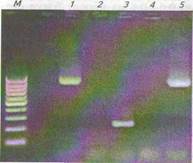
Рис.9.Электрофореграмма продуктовОТ—ПЦР с препаратами нуклеиновых
кислот, выделенных из клубней картофеля, и праймерами, подобранными для
амплификации фрагмента гена пататина(№Х03932 по каталогу N081,
праймеры ограничивают фрагмент между 833и 1832 п.н.):
М — маркер молекулярной массы Сепе Ruler
100 bp DNA Ladder (размер фрагментов —
100, 200, 300, 400, 500, 600, 700, 800, 900 и
1000 п.н.); 1 — препарат тотальной РНК без
очистки от ДНК (продукт ПЦР без ОТ); 2 —
препарат тотальной РНК после обработки
ДНКазой (продукт ПЦР без ОТ); 3 — препа-
рат кДНК (продукт ОТ-ПЦР); 4 — отрица-
тельный контроль (стерильная деионизован-
ная вода); 5 — положительный контроль
(ДНК, выделенная из клубней картофеля, —
продукт ПЦР)
Практическая работа №10
РЕСТРИКЦИОННЫЙ АНАЛИЗ ДНК
Рестриктазы — это ферменты, обладающие эндонуклеазной
активностью, которые специфически гидролизуют молекулы
двухцепочечных ДНК при наличии в них определенных последовательностей нуклеотидов — сайтов рестрикции. Название этих
ферментов происходит от английского гезгпсИоп (ограничения);
они были выявлены у определенных штаммом бактерий. Крайне
редко помимо эндонуклеазной активности рестриктаза обладает
еще и метилазной (Есо571), производя модификацию (метилирование) определенных нуклеотидов в последовательности, узнаваемой рестриктазой; такие модифицированные последовательности не подвержены ферментативной рестрикции. Но обычно эти фер-менты структурно независимы и работают в комплексе, образуя
так называемую КМ-систему (систему рестрикции—модификации). Одновременное наличие в клетке обеих ферментативных активностей защищает от интеграции в геном чужеродной ДНК (например, вирусов или плазмид) и предотвращает разрушение собственной ДНК.
Известно около 2500 рестриктаз. Название того или иного фермента составляется из первой буквы рода и двух первых букв вида
бактерии, из которой данная рестриктаза выделена, еще одна буква может обозначать тип штамма. Если в определенном штамме
клеток имеется несколько рестриктаз, то к буквенному названию
фермента добавляется числовое обозначение. Например — рестриктаза Hind III выделена изклеток Haemophilus influenzae с серотипом d и относится к III классу RМ-системы.
Рестриктазы могут кодироваться не только геномной ДНК бактерии, но также плазмидами и фагами, в связи с этим к названию
фермента добавляется название внехромосомного элемента (ЕсоRI).
Сучетом основных свойств рестриктазы подразделяют на четыре класса.
Рестриктазы I классадействуют в одном комплексе с метилазами, расщепляют ДНК в произвольных местах на расстоянии от нескольких сот до нескольких тысяч пар нуклеотидов от
несимметричных сайтов узнавания. При этом образуется сплошной спектр рестриктов, не детерминированных по размерам и содержанию информации, поэтому данные рестриктазы в генной инженерии не используют. Примером таких рестриктаз может
служить ЕсоК.
Рестриктазы II класса имеют широкое применение,
поскольку рестриктазы и метилазы этого класса действуют независимо, сайты узнавания совпадают с сайтами расщепления или
находятся рядом с ними на определенном расстоянии, в результате чего получаются фрагменты ДНК воспроизводимого состава и
длины (рис. 10).
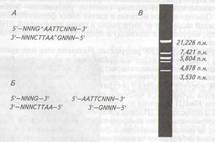


Более половины рестриктаз данного класса узнают нуклеотидные последовательности с вращательной симметрией второго порядка (палиндромы). По способу расщепления данные ферменты делятся на два подкласса. Представители первого осуществляют
ступенчатый разрез комплементарных нитей ДНК, в результате
чего образуются фрагменты с выступающими (липкими) концами: либо 5'-концами (рис.10, Б), либоЗ'-концами,как в случае действия рестриктазы Pst I(рис. II, А)- Ферменты второго подкласса (например, Sma I ) расщепляют совпадающие связи, в результате чего образуются фрагменты с ровными (тупыми) концами (рис. 11, В).
Рестриктазы III класса (например, Есо PI ) действуют в одном комплексе с метилазами и узнают несимметричные последовательности нуклеотидов, при этом расщепление происходит на определенном расстоянии от сайта узнавания.
R.М-система (комплекс рестриктазы и метилазы) IV класса
представлена пока уникальным ферментом Есо57 I, в одной поли-
пептидной цепочке которого и эндонуклеазная, и метилазная ак-
тивность.
Рестриктазы широко используют в работах по генной инжене-
рии, в частности по картированию геномов, клонированию, оп-
ределению нуклеотидных последовательностей (секвенирова-
нию).
За единицу активности рестриктазы принимают количество
фермента, способное за 1 ч в оптимальных для него условиях полностью гидролизовать 1 мкг ДНК фага λ. Для проведения успешной рестрикции необходимо соблюдать ряд условий,которые приведены в таблице 7.
7.Условия рестрикции
| Фактор | Требование | Дополнительная информация |
| Рестриктаза | 1. Тип — в зависимости от цели работы. | Для выявления сайтов использу- ют генетические карты или сек- венированные последовательно- сти ДНК |
| При выборе необходимо знать,есть ли в используемой ДНКсайт или сайты узнавания для данной рестриктазы | Большой избыток активности рестриктазы или объема ее ра- створа, взятого на реакцию (бо- лее 1/10 конечного объема), мо- жет привести к уменьшению специфичности работы фермента | |
| 2. Количество —в зависимости отколичества ДНК (1 ед.акт. фермента на 1 мкг ДНК). Длябольшей эффективности лучше использовать двух- или трехкратный избыток фермента | ||
| Буферный раствор | Состав: 1) трис-НС1 буферный раствор для поддержания рН (около 7,5); 2)МgС12 (ионы магния являются единственным кофактором рестриктаз класса II); 3)дитиотрейтол или 2-меркапто-этанол для стабилизации фер- мента с добавлением бычьего сывороточного альбумина (БСА)как стабилизатора; 4) NaCI (или КС1) для создания необходимой ионной силы реак- ционной смеси | Для различных рестриктаз требу- ются определенные концентра- ции компонентов. Однако для удобства работы большинство ферментов было объединено в 4—5 групп и для каждой из них был унифицирован состав реак- ционного буфера (как правило, переменной величиной является концентрация ионов Na+) |
| ДНК | От 1 до 10 мкг, поскольку большие количества ДНК увеличивают вязкость раствора, что приво- дит к ингибированию реакции | ДНК должна быть очищена от реагентов, используемых полиса- харидов и РНК |
| Объем смеси | От 10 до 50 мкл | Для уменьшения испарения и поддержания постоянного объ- ема реакционной смеси добавля- ют вазелиновое масло |
| Температура | 37°С для большинства рестриктаз | 25 °С (для SmaI), 65 °С (для ре- стриктаз из термофильных бак- терий — ВstB I, Таg 1и др.) |
| Время | От 1 до 5 ч | Реакцию можно остановить с по- мощью ЭДТА—Na |
Разделение полученных рестриктазных фрагментов и их визуа-
лизацию проводят методом электрофореза в агарозном геле.
Цель работы. Ознакомиться с методом рестрикционного анали-
за ДНК.
Оборудование и материалы. 1. Микроцентрифуга высокоскоростная до 10 000g.
2. Микроцентрифуга-вортекс до 2000g- 3. Термостат твердотельный для микро-
пробирок вместимостью 0,5—1,5 мл. 4. Автоматические дозаторы переменного
объема с наконечниками. 5. Микропробирки вместимостью 0,5 мл. 6. Термостат
твердотельный с функцией охлаждения для микропробирок вместимостью до
1,5 мл. 7. Рестриктаза Есо RIи буферный раствор для нее. 8. Раствор плазмидной
ДНК (рGEM3Z) и ДНК фага λ. 9. Вода стерильная деионизованная. 10. Материа-
лы и оборудование для проведения электрофореза, представленные в практичес-
кой работе № 2.
Ход работы. 1. Смесь для рестрикции (общий объем — 40 мкл)
готовят в микропробирке вместимостью 0,5 мл, поместив ее и все
исходные компоненты в термостат с функцией охлаждения при
4°С:
10х буфер для рестриктазы ЕсоR I! — 6 мкл;
рестриктаза ЕсоR I. (10ед.)— 2 мкл;
вода стерильная деионизованная — 32 мкл.
Вышеперечисленные компоненты смешивают в указанных количествах, с помощью автоматического дозатора отбирают по 20 мкл смеси и переносят в две чистые микропробирки вместимостью 0,5 мл.
Внимание! При смешивании необходимо проводить смену наконечников после каждого раствора.
В пробирку 1 (промаркировав ее) добавляют 10 мкл раствора
ДНК фага λв концентрации 0,4 мкг/мкл, а в пробирку 2 (промаркировав ее) — 10 мкл раствора плазмидной ДНК (рGEM3Z) в концентрации 0,4 мкг/мкл.
2.Смеси в двух пробирках очень осторожно перемешивают с
использованием дозатора с наконечником, добавляют 10 мкл минерального масла, центрифугируют 5 с при 2000g и выдерживают
в термостате 1 ч при 37 oС.
3.Через 5, 20, 40 мин и по истечении 1 ч от начала рестрикции
из пробирки 2 отбирают пробы по 5 мкл и переносят в чистые
микропробирки вместимостью 0,5 мл, маркируя их при этом.
4.Каждую из отобранных проб сразу же смешивают с 5 мкл
краски-лидера (из набора для электрофореза), помещают в термостат с функцией охлаждения при 4 °С и оставляют до тех пор, пока
не будет отобрана последняя проба.
5.Четыре содержащие гидролизованную ДНК пробы, отобранные из пробирки 2, а также пробу из пробирки 1 (аналогично смешанную с краской-лидером) вносят в лунки пластины агарозного геля и подвергают электрофорезу для исследования динамики ре-стрикции (см. практическую работу № 2).
6.Полученные результаты регистрируют визуально или с ис-
пользованием видеосистемы.
Контрольные вопросы. 1. Какова функция рестриктаз в клетках бактерий?
2. Каковы принципы деления рестриктаз на классы? 3. Что такое сайт рестрикции?
4. Какие сайты рестрикции узнают рестриктазы II класса? 5. По какому принципу
делят II класс на подклассы? 6. Каковы основные условия проведения рестрик-
ции? 7. Какой показатель принимают за единицу активности рестриктазы?
Задания.1. Поместить схему или фотографию полученной
электрофореграммы в рабочий журнал, пронумеровать дорожки и
сделать подписи к ним. 2. Проанализируйте динамику рестрикции
ДНК рGEM3Z при действии рестриктазы ЕсоR I(по результатам
рестрикции с разными сроками инкубации).
Практическая работа №11
ДНК—ДНК-ГИБРИДИЗАЦИЯ
Методы гибридизации нуклеиновых кислот основаны на способности олиго- и полинуклеотидов образовывать двухцепочечную структуру за счет образования водородных связей между ос татками комплементарных азотистых оснований: аденин + тимин (или урацил) и гуанин + цитозин. При соблюдении определенных
условий, исключающих случайное неканоническое взаимодействие нуклеотидов, методы гибридизации нуклеиновых кислот
позволяют выявить гомологию первичной структуры интересующей нас нуклеиновой кислоты (мишень) и зонда — олигонуклеотида с известной первичной структурой. Мишенью может служить, например, нативная ДНК (дот-гибридизация от англ. скл —
точка, точечный), а также рестрикционные фрагменты ДНК (Сау-
зерн-гибридизация) или фракционированные с помощью электрофореза молекулы РНК (Нозерн-гибридизация, рис. 12), а зондом — чаще всего ПЦР-продукт или рестрикционный фрагмент,меченный радиоактивным изотопом (чаще 32Р или 33Р) или флуоресцентным красителем для его последующей детекции. Использование радиоактивных изотопов становится все менее популярным из-за невозможности длительного хранения меток, трудностей детекции продуктов ядерного распада и определенного вреда,наносимого здоровью систематической работой с ними. Однако
флуоресцентное мечение также имеет свои недостатки, это прежде всего высокая термолабильность как самой молекулы флуорофора, так и химической связи флуорофора с зондом, которая нарушается при нагреве—охлаждении, детекции коротковолновым или УФ-светом, а также в ходе длительного хранения.
К отдельной категории методов гибридизации следует отнести
гибридизацию in situ, проводимую непосредственно на живом
объекте, точнее, внутри прозрачных для детекции клеток, тканей,
органов. Основное предназначение этого метода — определение
клеточной и тканевой локализации РНК- или ДНК-мишени с уже
известной первичной структурой или распределения определенных последовательностей ДНК в хромосомах. Метод позволяет установить, например, тканеспецифичность вирусов и бактерий (пораспределению их наследственного материала по клеткам и тканям организма-хозяина), экспрессии определенных генов (по наличию мРНК) и т. д. (рис. 13).

Рис. 12. Радиоавтограф мембраны после Нозерн-гибридизации, мишень — мРНК из
растений разных фенотипов Arabidopsis Thaliana, зонд 32Р-меченый олигонуклеотид
(Nam and Li, 2002)
Дот-гибридизация — самая простая разновидность ДНК—
ДНК-гибридизации (мишень и зонд являются молекулами ДНК).
ДНК-мишень не подвергают каким-либо модификациям, а только плавят (денатурируют) при 65 °С в 0,1-0,5 М растворе щелочи
и закрепляют на специальной подложке — нитроцеллюлозой
или нейлоновой мембране, реже
|
|
|


