 |
Устранение мешающих ионов путем удаления их из раствора
|
|
|
|
В тех случаях, когда невозможно провести маскировку мешающих ионов, их разделяют, экстракцией или осаждением, используя различное отношение катионов к общим реагентам: щелочам, водному раствору аммиака, растворимым в воде хлоридам, сульфатам, карбонатам, металлическому цинку и различным осадкам.
Одним из способов устранения влияния мешающих ионов является экстракция органическими растворителями. Подбирают органический растворитель, не смешивающийся с водой, так, чтобы обнаруживаемый и мешающие ионы были в разных фазах. Чаще всего в органический слой переводят обнаруживаемый ион. В качестве экстрагентов применяют толуол, бензол, изоамиловый спирт, четыреххлористый углерод, хлороформ и др.
Например, обнаружению Со2+ в виде синего тиоцианатного комплекса [Со(SCN)4]2- мешает Вi3+, образующий с SCN- ионами окрашенный в желтый цвет комплекс [Вi(SCN)4]-. В присутствии Вi3+ комплекс кобальта [Со(SCN)4]2- экстрагируют изоамиловым спиртом, а соединение висмута остается в водном растворе.
При экстракции происходят концентрирование вещества в слое органического растворителя и увеличение интенсивности его окраски. Кроме того, в органическом растворителе, менее полярном, чем вода, диссоциация уменьшается и увеличивается устойчивость комплексных соединений. Это способствует повышению чувствительности реакции.
Устранить мешающие ионы можно осаждением их с помощью общих реагентов. Например, для обнаружения катионов щелочных металлов все мешающие катионы осаждают действием карбоната натрия или калия. После центрифугирования и отделения осадка в растворе проводят специфичные реакции на ионы K+ (Na+). Либо, наоборот, можно перевести обнаруживаемый ион с небольшой группой других ионов в осадок. После отделения и растворения осадка определяемый ион обнаруживают характерной реакцией. Для разделения ионов данным способом используются общие реагенты: едкие щелочи, водный раствор аммиака, растворимые в воде хлориды, сульфаты, карбонаты, гидрофосфат, металлический цинк. Кроме того, используют суспензии различных осадков, отделяющие мешающие ионы.
|
|
|
Провести разделение ионов и устранить мешающее действие посторонних ионов позволяет особый прием — проведение реакций капельным методом на фильтровальной бумаге (осадочная хроматография на бумаге). Способность адсорбироваться на поверхности фильтровальной бумаги у различных ионов разная. Поэтому и способность перемещаться вслед за фронтом растворителя также различается, осадки по поверхности фильтровальной бумаги практически не перемещаются. За счет этого происходят разделение компонентов смеси, концентрирование и их возможное обнаружение действием специфичных реагентов на различные зоны реакционного пятна на фильтровальной бумаге.
Например, при совместном присутствии в растворе хромат-иона CrO42- и марганца (II) Mn2+ каплю раствора наносят на фильтровальную бумагу, добавляют каплю гидроксида натрия, выдерживают 2-3 мин на воздухе. При этом протекают реакции:
Mn2+ + 2OH- → Mn(OH)2↓
2Mn(OH)2 + O2 → 2MnO2↓ + 2H2O
Образовавшийся осадок диоксида марганца (IV) остается в центре пятна на фильтровальной бумаге, растворимый хромат-ион вымывается на периферию пятна дополнительной каплей воды. Добавление бензидина —индикатора на окислители — окрашивает в синий цвет две зоны: центр и периферию пятна, что доказывает присутствие в исходном растворе хромат-иона CrO42- и марганца (II) Mn2+.
Контрольные вопросы
1. Почему необходимо устранение посторонних ионов?
2. Что такое маскировка, какие методы маскировки применяются в качественном анализе?
|
|
|
3. Какие методы удаления применяются в качественном анализе?
4. На чем основано проведение реакций обнаружения капельным методом на фильтровальной бумаге?
6. Почему комплексообразование используют для маскировки?
7. Почему изменение рН раствора используют для маскировки?
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 240-243.
2. Золотов Ю.А., Дорохова Е.Н., Фадеева В.И. и др. Основы аналитической химии: учебник для вузов. В 2 кн. Кн.1. Общие вопросы. Методы разделения /под ред. Ю.А. Золотова. - М.: Высшая школа, 2004.— С. 207-212.
А.Т. Чанышева, О.Б. Чалова
Лекция 7. Образование осадков. Произведение растворимости
Ключевые слова: произведение растворимости, произведение концентраций (активностей), растворимость, ионная сила раствора, солевой эффект.
При использовании аналитических реакций, основанных на образовании осадков, первостепенное значение имеет полнота осаждения вещества из раствора. Необходимо, чтобы остаточное содержание в растворе осаждаемого вещества не превышало ~10-6 моль/л. В таких случаях осаждение считают полным. Полнота осаждения осадков и растворимость осадка зависят от ряда факторов, важнейшими из которых являются: природа осаждаемого вещества, природа осадителя, свойства растворителя; концентрация реагентов; температура; рН среды; присутствие посторонних веществ, как имеющих, так и не имеющих одноименные ионы с осадком. Чистота образующегося осадка зависит от условий осаждения: быстрое или медленное образование осадка, осаждение из разбавленных или концентрированных растворов, при перемешивании или без перемешивания, структура образующегося осадка (аморфный, кристаллический); возможность протекания побочных реакций; продолжительность выдерживания осадка под маточным раствором.
Выполняя такие аналитические операции, как осаждение или отделение, промывание и растворение осадков, имеют дело с гетерогенными системами. Над осадком находится насыщенный раствор электролита, в котором устанавливается равновесие между твердой фазой и перешедшими в раствор ионами электролита. Например, равновесие между осадком ортофосфата свинца (II) и находящимися в растворе ионами можно выразить уравнением
|
|
|
Pb3(PO4)2↓  3Pb2+ + 2PO43-
3Pb2+ + 2PO43-
твердая фаза насыщенный раствор
Равновесие между твердой фазой и насыщенным раствором плохо растворимого сильного электролита характеризуется константой равновесия — произведением растворимости — одной из важнейших характеристик осадка.
ПРPb3(PO4)2 = (a Pb2+)3∙(a PO43-)2 ,
где a Pb2+ и a PO43- — активные концентрации (активности) соответствующих ионов Pb2+ и PO43- в насыщенном растворе.
Для разбавленных растворов электролитов, в которых ионная сила незначительна, коэффициенты активности ионов близки к 1 и активности ионов совпадают с молярной концентрацией, поэтому можно записать:
ПРPb3(PO4)2 = [Pb2+ ]3 [PO43-]2,
где [Pb2+ ] и [PO43-] — молярные концентрации соответствующих ионов в насыщенном растворе.
Малорастворимые соединения начинают выпадать в осадок из перенасыщенных растворов, если произведение концентраций (активностей) его ионов (ПК) превышают значение его ПР при данной температуре, то есть выполняется условие: ПК > ПР.
Значение ПР используют для выбора условий, необходимых для перевода осадков в раствор. Осадки электролитов растворяются в ненасыщенных растворах, для которых выполняются условие: ПК< ПР.
Не следует смешивать понятия растворимость и ПР. Растворимость — количество вещества, которое может раствориться в заданном количестве растворителя. Ее выражают в граммах на 100 г (1000 г) воды или в моль/л. Растворимость плохо растворимого сильного электролита можно рассчитать через ПР.
Пример. Зная произведение растворимости бромата серебра (I), равное ПР AgBrO3 =5,5∙10-5, найти растворимость этой соли в воде в г∕л и моль∕л.
Решение. Значение ПР велико, следует учитывать ионную силу раствора и активность ионов, а не концентрации. Для вычисления ионной силы раствора определим приближенные значения концентраций ионов в растворе:
ПРАgBrO3≈[Аg+][ BrO3−], так как [Аg+]=[ BrO3−], то
[Аg+] = [BrO3−] ≈ 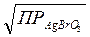 =
= 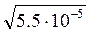 = 7,4∙10-3 ≈ 0,00074 моль/л.
= 7,4∙10-3 ≈ 0,00074 моль/л.
|
|
|
Ионная сила раствора составит ≈0,00074, а величины коэффициентов активности будут равны: f Аg+ = fBrO3− ≈0,9. Значения коэффициентов активности рассчитывают или выписывают из справочной таблицы.
Обозначим растворимость бромата серебра через S и найдем ее с учетом коэффициентов активности S = [Аg+]=[ BrO3−], тогда
ПРАgBrO3 = а Аg+∙ а BrO3− = fАg+ ∙[Аg+]∙f BrO3−∙[BrO3−],
где а Аg+∙и а BrO3− — активные концентрации соответственно ионов Аg+ и BrO3−; f Аg+ и f BrO3− — коэффициенты активности соответствующих ионов; [Аg+] и [BrO3−] — молярные концентрации ионов в насыщенном растворе.
Получаем уравнение: (0,9)2∙S2 = 5,5∙10-5. 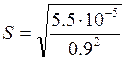 = 8,2∙10-3 моль/л.
= 8,2∙10-3 моль/л.
Умножая результат на молярную массу M (АgBrO3) = 235,8 г/моль, получим растворимость АgBrO3 в г/л: C = 8,2∙10-3∙235,8 = 1,93 г/л.
Если считать без учета ионной силы раствора и коэффициента активности, С′ = 1,74 г/л. Ошибка определения растворимости составит 9,8%.
По величине ПР можно сравнивать растворимость однотипных соединений, например, PbSO4, PbCrO4, PbS: чем меньше ПР, тем меньше растворимость. В общем случае растворимость соединений, диссоциирующих на разное число ионов, рассчитывается по разным формулам.
Например, растворимость Pb3(PO4)2 в воде можно рассчитать из соотношения ПРPb3(PO4)2 = [Pb2+ ]3 [PO43-]2 = (3S)3∙(2S)2.
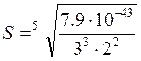 = 1,49∙10-9 моль/л.
= 1,49∙10-9 моль/л.
Чем меньше растворимость соединения, тем более полно оно выделяется из раствора. Например, ион Pb2+ можно осадить в виде осадков, представленных в таблице. Наиболее растворим — PbCl2, наименее растворим — PbS.
| Осадок | PbCl2 | PbSO4 | PbCrO4 | PbS | Pb3(PO4)2 |
| ПР | 1,6·10-5 | 2,2·10-8 | 1,8·10-14 | 2,5·10-27 | 7,9·10-43 |
| Растворимость, моль/л | 1,59∙10-2 | 1,48∙10-4 | 1,34∙10-7 | 5,0∙10-14 | 1,49∙10-9 |
Уменьшить растворимость осадка можно, добавив избыток осадителя.
Например, рассчитаем растворимость бромата серебра(I), если в растворе одновременно присутствует 0,1 моль/л бромата калия.
Решение. Учитывая полную диссоциацию хорошо растворимого бромата калия, концентрация [BrO3−] = 0,1 + S ≈ 0,1 моль/л.
1. Без учета ионной силы раствора получаем соотношение
ПРАgBrO3= [Аg+]∙[BrO3−] = S∙0,1.
Отсюда S = [Аg+] = 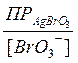 =
= 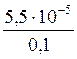 = 5,5∙10-4 моль/л.
= 5,5∙10-4 моль/л.
Таким образом, в присутствии «одноименного иона» растворимость плохо растворимого сильного электролита уменьшается. Поэтому для полноты осаждения применяют избыток осадителя.
2. С учетом ионной силы раствора расчет следует провести по соотношению: ПРАgBrO3= а Аg+∙ а BrO3− = f Аg+∙[Аg+]∙f BrO3−∙[BrO3−].
Учитывая присутствие в растворе хорошо растворимой соли, ионная сила равна: I = 0,5∙[0,1(+1)2 + 0,1(-1)2] = 0,1. По таблице определяем коэффициенты активности: f Аg+ = f BrO3− = 0,77. Получаем уравнение: ПРАgBrO3=0,77∙ S∙0,77∙0,1.
|
|
|
Отсюда S = [Аg+] = 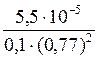 = 9,27∙10-4 моль/л.
= 9,27∙10-4 моль/л.
Таким образом, в присутствии хорошо растворимых сильных электролитов с увеличением ионной силы раствора растворимость плохо растворимых электролитов возрастает в 1,5-3 раза («солевой эффект»). Поэтому для полного осаждения применяют не более чем 1,5-кратный избыток осадителя.
Контрольные вопросы
1. Что такое произведение растворимости и растворимость?
2. От чего зависят полнота осаждения и чистота получаемого осадка?
3. Как рассчитывается растворимость осадка электролита в воде?
4. Как рассчитывается растворимость в растворе соли, содержащей одноименные с осадком ионы без учета и с учетом ионной силы раствора?
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 84-100.
2. Хаханина Т.И. Аналитическая химия: учеб. пособие. - 2-е изд., перераб. и доп. /Т.И.Хаханина, Н.Г.Никитина. - М.: Изд-во «Юрайт»; Высшее образование, 2010. – С. 27-30, 162-164.
А.Т.Чанышева
Лекция 8. Реакции разделения. Дробное осаждение
Ключевые слова: реакции разделения, осадитель, требования к реакциям осаждения, центрифугирование, центрифугат, промывание осадка, дробное осаждение.
Реакции разделения применяются в систематическом химическом анализе, когда присутствие одних ионов мешает обнаружению других ионов, при этом используются реактивы, способные отделить один или несколько ионов в виде осадка или путем растворения осадка.
Требования к реакциям разделения:
- реакции должны протекать быстро;
- для полноты осаждения продукты должны иметь малую растворимость (S≤10−6 моль/л);
- желательно чтобы получающиеся осадки имели кристаллическую структуру;
- необходимо поддерживать нужное значение рH раствора, так как осадки, выпадающие в кислой среде, не выпадут в щелочной среде, и наоборот.
К анализируемому раствору в конической пробирке по каплям добавляют соответствующий реактив − осадитель, перемешивая раствор. После выпадения осадка проверяют полноту осаждения: как только жидкость над осадком станет прозрачной, добавляют ещё каплю осадителя. Если в растворе не появится муть, полнота осаждения достигнута. В противном случае добавляют ещё несколько капель осадителя. Если для проведения осаждения необходимо нагревать раствор, то пробирки помещают в водяную баню.
Для отделения осадков от растворов в качественном полумикроанализе применяют центрифугирование. После окончания центрифугирования плотный осадок остаётся на дне пробирки, а центрифугат (надосадочная жидкость) при этом осветляется и легко отделяется пипеткой или сливанием. Перед анализом осадка его промывают 2-3 раза небольшим количеством дистиллированной воды или промывной жидкости, каждый раз перемешивая и отделяя фильтрат центрифугированием. Для уменьшения растворимости осадков в промывную воду добавляют несколько капель осадителя. Надо иметь в виду, что при большом избытке осадителя многие осадки начинают растворяться, поэтому рекомендуется избыток не более 20-50 %.
Очень важным в качественном анализе является дробное осаждение одного из определяемых компонентов. Рассмотрим действие раствора соли AgNO3 на раствор смеси солей КCl и K2CrO4.
Пусть концентрация [Cl-] = [CrO42-] = 0,1 моль/л, образование осадков протекает по уравнениям реакций:
Ag+ + Cl-→ AgCl↓, ПРAgCl =1,56∙10-10
2 Ag++ CrO42-→ Ag2CrO4↓, ПРAg2CrO4=9∙10-12 .
Осадок образуется из перенасыщенного раствора, если выполняется условие: ПК > ПР.
Значения концентраций Ag+, требующихся для начала осаждения AgCl и Ag2CrO4, можно вычислить из произведений растворимости:
ПРAgCl = [Ag+]∙[Cl-] = 1,56∙10-10
Выпадение осадка AgCl начинается при условии
[Ag+](для осаждения AgCl) ≥ ПР AgCl /[ Cl-]= 1,56∙10-10 /0,1=1,56∙10-9 моль/л;
Учитывая, что ПРAg2CrO4 = [Ag+]2∙[ CrO42-] = 9∙10-12
выпадение осадка Ag2CrO4 начинается при условии
[Ag+](для осаждения Ag2CrO4) ≥ 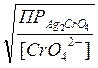 =
= 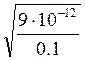 = 9,5∙10-6 моль/л.
= 9,5∙10-6 моль/л.
Итак, осаждение AgCl начинается при достижении концентрации ионов серебра 1,56∙10-9 моль/л, осаждение Ag2CrO4 — при достижении большей концентрации ионов серебра — 9,5∙10-6 моль/л. Таким образом, первым будет осаждаться AgCl. В этом можно убедиться на опыте, если смешать в пробирке по несколько капель растворов КCl и K2CrO4 одинаковой концентрации и прибавлять по каплям раствор AgNO3, перемешивая содержимое пробирки. При этом сначала выпадает белый творожистый осадок AgCl, а затем кирпично-красный осадок Ag2CrO4. Следовательно, осаждение ионов CrO42- начнется только после почти полного удаления из раствора ионов Cl-. Таким образом, осаждение ионов из смеси происходит в той последовательности, в какой достигаются произведения растворимости трудно растворимых соединений, образующихся при действии данного реактива. Такое осаждение называется дробным. Последовательность осаждения ионов зависит:
-от произведения растворимости,
- молярной растворимости (S, моль/л),
- концентрации ионов электролита в растворе.
Для дробного осаждения можно использовать насыщенные растворы плохо растворимых электролитов. Прибавление насыщенного водного раствора CaSO4 к водным растворам солей катионов Sr2+; Pb2+; Bа2+ приводит к помутнению растворов вследствие образования осадков сульфатов SrSO4, PbSO4 и BаSO4, так как эти сульфаты менее растворимы в воде, чем сульфат кальция CaSO4. Прибавление насыщенного раствора SrSO4 к растворам солей кальция, бария и свинца осаждает сульфаты BаSO4 и PbSO4. Сульфат бария BаSO4 избирательно осаждается действием на анализируемый раствор суспензии сульфата свинца PbSO4. Это можно объяснить, сравнивая их произведения растворимости и условия образования осадка (ПК>ПР).
PbSO4↓ + Bа2+ → BаSO4↓ + Pb2+
Константа равновесия может быть рассчитана следующим образом.
Кравн =  =
=  ∙
∙ 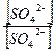 =
= 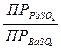 =
= 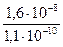 = 1,05∙102 >1.
= 1,05∙102 >1.
Чем больше различие между значениями ПР однотипных малорастворимых сильных электролитов, тем больше Кравн и легче провести дробное (избирательное) осаждение и дробное (избирательное) растворение.
Таким образом, при дробном осаждении в первую очередь осаждается наименее растворимое соединение, для которого первым выполняется условие (ПК > ПР).
Процессы превращения одних трудно растворимых соединений в другие могут быть использованы для разделения ионов при их дробном открытии. Трудно растворимые в воде реактивы, применяемые в качестве осадителей, имеют значительные преимущества перед легко растворимыми вследствие более избирательного действия.
Например, ионы Cu2+ можно осадить действием суспензии —насыщенного раствора CdS, содержащего твердую фазу. Концентрация ионов S2- в насыщенном растворе CdS составляет всего:
[S2-] = 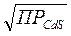 =
= 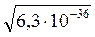 = 2,51∙10-18 [моль/л]
= 2,51∙10-18 [моль/л]
Столь незначительной концентрацией ионов S2- могут быть осаждены только сульфиды с очень малой растворимостью: PbS, CuS, Ag2S, HgS. Более растворимые сульфиды: MnS, FeS, CoS, NiS, действием суспензии CdS не осаждаются.
Например, с раствором соли меди количественно протекает реакция
CdS↓ + Cu2+ → CuS↓ + Cd2+
Константа равновесия реакции равна
Кравн = 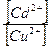 =
= 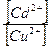 ∙
∙ 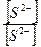 =
=  =
=  = 1,25∙109.
= 1,25∙109.
Таким способом можно отделить ионы меди от кобальта, никеля и др.
Аналогичные реакции могут быть использованы для отделения анионов. Например, в дробном методе обнаружения S2O32--ионов для устранения мешающего действия S2--ионов при их совместном присутствии на анализируемый раствор действуют суспензией PbSO4, в осадок переходит PbS, а в растворе остаются S2O32--ионы.
PbSO4 + S2- → PbS + SO42-
Кравн = 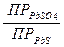 =
= 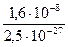 = 6.4∙1020
= 6.4∙1020
Контрольные вопросы
1. Что такое реакции разделения и какие требования к ним предъявляют?
2. От чего зависит последовательность осаждения ионов из смеси?
3. Что такое дробное осаждение?
4. Как рассчитать константу равновесия для превращения одного осадка в другой?
5. Почему трудно растворимые осадители предпочтительнее хорошо растворимых?
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 93-97.
2. Золотов Ю.А., Дорохова Е.Н., Фадеева В.И. и др. Основы аналитической химии: учебник для вузов. В 2 кн. Кн.1. Общие вопросы. Методы разделения /под ред. Ю.А. Золотова. - М.: Высшая школа, 2004. — С. 192-203.
А.Т. Чанышева, О.Б.Чалова
Лекция 9. Влияние различных факторов на растворение осадков
Ключевые слова: осадок, растворимость, факторы, влияющие на растворимость.
Растворимость соединений в воде является их характеристичным свойством и используется в качественном химическом анализе. Например, в систематическом анализе для разделения катионов на группы.
Общей теории, объясняющей растворимость химических соединений, не существует. Наиболее важной характеристикой, определяющей растворимость, является тип химической связи, в данном случае находит проявление эмпирическое правило: «подобное растворяется в подобном». Полярные соединения лучше растворяются в полярных растворителях, неполярные — в неполярных растворителях. Строгие количественные критерии, позволяющие связать растворимость с физико-химической природой катиона и аниона, образующих соль, отсутствуют. Растворимость является сложной функцией:
- энергии кристаллической решетки;
- энергии сольватации (гидратации) катиона и аниона;
- поляризующей способности катиона и поляризуемости аниона;
- соотношения радиусов катиона и аниона.
Можно привести некоторые качественные закономерности, характеризующие растворимость солей в воде. Так, практически все соли одноосновных кислородсодержащих кислот (нитраты, перхлораты, ацетаты и т. д.) хорошо растворимы в воде. Хорошей растворимостью, как правило, обладают кислые соли независимо от природы катиона и аниона. Основные соли плохо растворимы в воде, за исключением основных солей сильных многоосновных оснований.
Закономерности растворимости средних солей многоосновных кислот более сложны. Нередко близкими значениями растворимости характеризуются соли разного состава, но относящиеся к одному структурному типу. Так соли кислот HXY4 и Cs сравнительно мало растворимы независимо от природы X и Y. Растворимость CsClO4, CsMnO4, CsReO4, CsBF4, CsIO4 и т. п. составляет от 0,01 до 0,07 моль/л. Растворимость солей бария крайне мала для всех кислот типа H2ЭO4 (Э= S, Se, Cr, Mo, W, Mn, Re, Fe, Ru, Os). Трудно растворимы также сульфаты Ca, Sr, Ba, Ra, Pb. С другой стороны, многие сульфаты p- и d-металлов хорошо растворимы в воде. Именно эти сульфаты склонны к образованию кристаллогидратов, в то время как малорастворимые сульфаты кристаллогидратов не образуют. Это служит указанием на существенную зависимость растворимости солей от способности катионов образовывать прочные аквакомплексы и значительную роль сольватационных эффектов в процессе растворения.
Как правило, чем меньше разница между радиусами катиона и аниона, тем прочнее образующееся соединение. Поэтому крупные катионы образуют малорастворимые соединения с крупными анионами. Например, большие однозарядные катионы K+, Rb+, Cs+, NH4+ образуют осадки с крупными же анионами ClO4-, [Co(NO2)6]3- и др.
Большинство осадков, получаемых в качественном и количественном анализе, представляют собой соединения преимущественно ионного характера: соли, основания или кислоты. Чаще всего в осадок выпадают соли (BaSO4, CaC2O4, AgCl). Во многих случаях катионы осаждают в виде гидроксидов и оксидов металлов — Al(OH)3, Fe(OH)3, CuO и др.
Факторы, влияющие на растворимость электролита:
1) природа вещества; 2) природа растворителя (полярность);
3) природа осадителя; 4) концентрация реагентов;
5) температура: большинство аналитических реакций растворения неорганических соединений являются эндотермическими, поэтому во многих случаях растворимость увеличивается с повышением температуры;
6) присутствие одноименного иона, понижающего растворимость;
7) присутствие посторонних электролитов, не имеющих с осадком общих ионов, увеличивает растворимость (солевой эффект);
8) структура образующегося осадка: аморфный, кристаллический;
9) продолжительность выдерживания осадка под маточным раствором;
10) рH влияет на растворимость соединений, проявляющих кислотно-основные свойства;
11) присутствие веществ, образующих комплексные соединения с катионом соли;
12) возможность протекания ОВР.
Большую роль при осаждении или растворении осадка играет рН среды, если осаждаемое вещество обладает кислотно-основными свойствами и вступает в реакции с кислотами или основаниями. Так, например, малорастворимые в чистой воде гидроксиды или карбонаты ряда металлов при понижении рН раствора при действии кислот растворяются. Фактически в таких случаях речь идет не о физическом растворении осадков, а об их химических реакциях с кислотами или основаниями. К аналогичным результатам приводят и реакции комплексообразования, например реакция растворения AgCl в присутствии избытка аммиака.
Контрольные вопросы
1. Какие факторы влияют на растворимость осадка?
2. Какие соли лучше растворимы: кислые, средние или основные?
3. Как влияет тип химической связи на растворимость?
4. Какие факторы влияют на растворимость осадка?
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 100-101.
2. Золотов Ю.А., Дорохова Е.Н., Фадеева В.И. и др. Основы аналитической химии: учебник для вузов. В 2 кн. Кн.1. Общие вопросы. Методы разделения /под ред. Ю.А. Золотова. - М.: Высшая школа, 2004.- С. 196-203.
А.Т. Чанышева, О.Б. Чалова
Лекция 10. Растворение осадков в результате химических реакций
Ключевые слова: направление протекания ионно-обменных реакций, константа равновесия, соли слабых кислот, гидроксиды металлов, комплексообразование.
Растворимость осадка увеличивается в присутствии ионов или молекул веществ, образующих с ионами осадка растворимые малодиссоциированные соединения (воду, слабую кислоту, комплексные соединения). В соответствии с принципом Ле-Шателье понижение концентрации Men+-иона или Ann--иона смещает равновесие растворения осадка вправо. В результате растворимость осадка возрастает.
MeAn↓  Men+ + Ann-
Men+ + Ann-
Свойства осадков, их способность растворяться в кислотах, щелочах, в растворах, содержащих лиганды, определяются кислотно-основными свойствами гидроксидов и кислот, соль которой рассматривается, а также склонностью элемента к комплексообразованию.
1. Как правило, растворимость солей слабых кислот увеличивается в более сильных кислотах в результате взаимодействий:
MeAn↓  Men+ + Ann-
Men+ + Ann-
Ann- + nH+  HnAn
HnAn
MeAn↓ + nH+  Men+ + HnAn
Men+ + HnAn
Ионы H+ связывают анионы соли в недиссоциированные молекулы слабой кислоты. В результате труднорастворимые соли слабых кислот растворяются в более сильных кислотах.
Например, фторид-ион реагирует с ионами водорода. При добавлении кислоты в насыщенный раствор фторида кальция устанавливаются два равновесия, и фторид кальция растворяется в кислоте в результате смещения равновесий вправо:
CaF2↓  Ca2+ + 2F-
Ca2+ + 2F-
2F- + 2H+  2 HF
2 HF
CaF2↓ + 2H+  Ca2+ + 2HF
Ca2+ + 2HF
Анионы сильных кислот протон не связывают, поэтому плохо растворимые соли сильных кислот, например BaSO4, SrSO4, AgCl, AgI и другие в кислотах не растворяются.
Возможность растворения соли слабой кислоты в сильной кислоте в стандартных условиях можно оценить по значению константы равновесия.
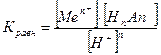 =
= 
 ; отсюда Кравн =
; отсюда Кравн = 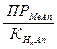 .
.
Кравн тем больше, чем больше ПР и растворимость и чем меньше КHnAn,то есть чем слабее кислота, соль которой рассматривается.
Ионно-обменные реакции термодинамически обратимы, но одно из направлений может быть предпочтительным и практически необратимым. Для определения направления протекания ионно-обменной реакции можно воспользоваться следующими эмпирическими закономерностями.
Если Кравн > 104, ионно-обменная реакция практически необратимо протекает в прямом направлении.
Если Кравн < 10-4, ионно-обменная реакция практически необратимо протекает в обратном направлении.
Если 10-4 ≤ Кравн ≤ 104, направление протекания ионно-обменной реакции можно менять, изменяя концентрацию исходных реагентов или продуктов.
Растворимость солей слабых кислот зависит от концентрации ионов Н+, то есть от рН раствора. Изменяя рН раствора можно осуществлять дробное осаждение. Например, BaCrO4 растворим в HCl (рН<4), но нерастворим в ацетатном буферном растворе (рН ≈4-5); SrCrO4 растворим в сильных и слабых кислотах, но нерастворим в нейтральной среде (рН≈7).
В сероводородном методе анализа сульфиды ионов Mn2+, Fe2+, Zn2+, Ni2+ осаждаются в нейтральной или слабощелочной среде действием (NH4)2S; в кислой среде они растворяются. Сульфиды Cd2+, Pb2+, Ag+, Cu2+, Hg2+ осаждаются сероводородом в кислой среде.
Труднорастворимые основания, например Fe(OH)3, Al(OH)3, Cr(OH)3, легко растворяются в кислотах. Растворение гидроксида происходит при различных значениях рН (см. лекцию 18) в зависимости от силы основания и растворимости гидроксида.
Труднорастворимые в воде кислоты можно растворить, связывая ионы H+ ионами OH- добавляемой щелочи:
H2WO4↓ + 2NaOH → Na2WO4 + 2H2O
2. Соли амфотерных гидроксидов могут растворяться в щелочах в результате образования гидроксокомплексов. Так, все соли Pb2+ (за исключением PbS) растворимы в растворе гидроксида натрия.
PbCrO4 ↓ + 4 OH- → [Pb(OH)4]2- + CrO42-
Кравн = ПРPbCrO4/ Кнест[Pb(OH)4]2- = (1.8∙10-14)/(10-13.3) = 1.8∙10-0.7
Таким образом, хромат свинца(II) растворяется в избытке концентрированной щелочи.
Соли сильных оснований (например, BaCrO4) в щелочах не растворяются. Это позволяет различить хромат свинца(II) и хромат бария.
3. Растворение осадка возможно за счет образования комплекса. Например: BiI3↓ + KI → K[BiI4]
Возможность образования комплексов является одной из причин, заставляющей избегать прибавления большого избытка осаждающего реактива при реакциях отделения.
Растворение осадка в результате комплексобразования можно представить на следующем примере:
AgX↓  Ag+ + X-
Ag+ + X-
AgX+ + 2NH3  [Ag(NH3)]+
[Ag(NH3)]+
AgX ↓ + 2NH3  [Ag(NH3)]+ + X-
[Ag(NH3)]+ + X-
Растворение солей в результате образования прочных комплексных соединений происходит, так как концентрация иона металла в растворе понижается и равновесие между раствором и осадком смещается вправо, осадок растворяется. Константу равновесия суммарного процесса можно рассчитать из соотношения
Кравн = ПРAgX/ Кнест[Ag(NH3)2]- = (ПРAgX)/(6,8∙10-8)
| AgX | AgCl | AgBr | AgI |
| ПР | 1,78∙10-10 | 5,3∙10-13 | 8,3∙10-17 |
| Кравн | 2,62∙10-3 | 7,79∙10-6 | 1,22∙10-9 |
Из значений констант равновесия следует, что хлорид серебра(I) растворяется в избытке концентрированного раствора аммиака. Для растворения йодида серебра (I) невозможно создать необходимую избыточную концентрацию аммиака (2024 моль/л). Поэтому AgI нерастворим в растворе аммиака, но может протекать обратная реакция — разрушения аммиакатного комплекса серебра действием йодид-ионов:
[Ag(NH3)]+ + I- → AgI ↓ + 2NH3
4. Катион металла из осадка можно перевести в раствор в результате окислительно-восстановительного процесса.
Например, сульфиды Cd2+, Pb2+, Ag+, Cu2+ характеризуются очень низкой растворимостью и в сильных кислотах не растворяются. При кипячении в растворе азотной кислоты растворение происходит в результате окисления сульфид-иона, например:
3CuS + 8HNO3 → 3Cu(NO3)2 + 3S +2NO + 4H2O
Сульфид ртути (II) растворяется только в «царской водке» — смеси концентрированных соляной и азотной кислот (1:3 по объему).
В некоторых случаях для растворения осадка необходимо восстановить какой-либо из входящих в его состав элементов. Например, осадок MnO(OH)2 или MnO2 не растворяется в H2SO4, но если прибавить к раствору нитрит (KNO2 или NaNO2), Mn(IV) восстанавливается до Mn(II) и растворение происходит в результате реакции
MnO(OH)2↓ + KNO2 + H2SO4 →MnSO4 + KNO3 + 2H2O
После чего проводят реакцию обнаружения иона Mn(II).
Контрольные вопросы
1. Какие соединения могут растворяться в кислотах?
2. Какие соединени
|
|
|


