 |
Деление катионов на аналитические группы по кислотно- основной классификации
|
|
|
|
| Название группы | Хлоридная | Сульфатная | Амфолитная | Гидроксидная | Аммиакатная | - |
| Номер группы | I | II | III | IV | V | VI |
| Катионы | Ag+; Pb2+; Hg22+ | Ca2+;Ba2+; Sr2+ | Al3+; Cr3+; Zn2+ | Fe2+; Fe3+; Mg2+; Mn2+; Bi3+ | Cu2+; Co2+; Ni2+ | K+; NH4+ |
| Групповой реагент | 2 н HCI | 2 н H2SO4 | 6 н NaOH избыток | NH4OH/(NaOH)* избыток | NH4OH (конц.) избыток | не имеется |
| Получаемые соединения | Белые осадки AgCl ПРAgCl =1,8∙10-10 PbCl2 ПРPbCl2=1,6∙10-5 Hg2Cl2 ПРHg2Cl2=1,3∙10-18 | Белые осадки CaSO4 ПРСаSO4=2,5∙10-5 SrSO4 ПРSrSO4=3,2∙10-7 BaSO4 ПРBaSO4=1,1∙10-10 | Раствор (фильтрат) Na[Al(OH)4] бесцветный Na[Cr(OH)4] зеленый Na2[Zn(OH)4] бесцветный | Осадки Fe(OH)2 ПРFe (OH)2=4,8∙10-16 Fe(OH)3 ПРFe(OH)3=3,8∙10-38 Mg(OH)2 ПРMg (OH)2=5∙10-12 Mn(OH)2 ПРMn(OH)2=4∙10-14 Bi(OH)3 ПРBi(OH)3=8,5∙10-22 | Раствор (фильтрат) [Cu (NH3)4](OH)2 Сине-фиолетовый [Co(NH3)6](OH)2 желтый (на воздухе окисляется до вишневого [Co(NH3)6](OH)3) [Ni(NH3)6](OH)2 синий | Раствор - K+; NH4+ |
| Характеристика соединений | Хлориды, не-растворимые в воде и кислотах | Сульфаты, не -растворимые в воде и кислотах | Амфотерные гидроксиды, растворимые в избытке сильной щёлочи | Гидроксиды, не- растворимые в избытке аммиака и сильной щелочи | Гидроксиды, растворимые в избытке аммиака | Хлориды, сульфаты и гидроксиды, растворимые в воде |
*Для отделения IV аналитической группы от III применяют избыток NaOH, для отделения IV аналитической группы
от V — избыток NH4OH.
аммиачно-фосфатная и кислотно-основная. В данном пособии рассмотрена кислотно-основная классификация, по которой катионы делят на шесть аналитических групп. В основе её лежит различие в растворимости образуемых катионами солей и гидроксидов, позволяющее отделять одни группы катионов от других (таблица). Согласно кислотно-основной классификации:
|
|
|
I аналитическая группа катионов - катионы Ag+, Pb2+, Hg22+, действие группового реагента 2н раствора хлороводородной кислоты НCl образует нерастворимые осадки хлоридов AgCl, PbCl2, Hg2Cl2 белого цвета, они отделяются от сложной смеси катионов в первую очередь.
I I аналитическая группа катионов - катионы Ca2+, Sr2+, Ba2+. При действии группового реагента 2н раствора серной кислоты H2SO4 образуются осадки соответствующих сульфатов белого цвета различной растворимости.
I II аналитическая группа катионов - катионы Аl3+, Cr3+, Zn2+. Групповым реагентом является 2н раствор гидроксида натрия NaOH (или калия KOH), при действии избытка которого образуются растворимые в воде комплексные соли, так как гидроксиды этих элементов амфотерны. Осадки Al(OH)3, Сr(OH)3 не растворяются в водном растворе аммиака (NH4OH), в котором Zn(OН)2 растворим с образованием бесцветного аммиачного комплекса [Zn(NH3)4]2+.
I V аналитическая группа катионов – катионы металлов Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, образующие основные гидроксиды, нерастворимые в избытке групповых реагентов водных растворов щелочи NaOH или аммиака NH4OH.
V аналитическая группа катионов - катионы Сu2+, Ni2+, Co2+. Групповым реагентом является избыток раствора аммиака NH4OH, при этом образуются ярко окрашенные растворимые в воде аммиакатные комплексы. При недостатке NH4OH катионы Сu2+, Ni2+,Cо2+осаждаются из растворов их хлоридов в виде основных хлоридов и гидроксидов: Cu(OH)2– голубой, CoOHCl– синий, Ni(OH)2– зеленый.
VI аналитическая группа катионов - катионы К+, NH4+, Na+, которые не осаждаются ни кислотами, ни щелочами. Эта группа не имеет группового реагента. Открывают их дробным методом в начале анализа, отделив катионы всех остальных аналитических групп действием карбоната натрия.
Контрольные вопросы
1. Дробный анализ и систематический анализ.
2. Классификация катионов по аналитическим группам.
3. Групповой реагент. Требования к групповому реагенту.
|
|
|
4. Действие групповых реагентов на катионы аналитических групп.
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 320-324.
2.Основы аналитической химии. Практическое руководство /под ред. акад. Ю.А. Золотова — М.: Высшая школа, 2001. — С. 119-124.
А.Т. Чанышева
Лекция 14. Анализ смеси катионов I аналитической группы
Ключевые слова: I аналитическая группа, соляная кислота, реакции разделения, реакции обнаружения катионов серебра (I), ртути (I), свинца (II)
При анализе смеси катионов I аналитической группы действие 2н раствора хлороводородной кислоты НCl на исследуемую смесь переводит катионы Ag+, Pb2+, Hg22+ в нерастворимые осадки белого цвета хлоридов AgCl, PbCl2, Hg2Cl2..
Ag+ + Cl- ® AgCl↓ ПРAgCl = 1,78∙10-10
Hg22+ + 2Cl- ® Hg2Cl2↓ ПРHg2Cl2 = 1,3∙10-18
Pb2+ + 2Cl- ® PbCl2↓ ПРPbCl2 = 1,6∙10-5
Наиболее растворим хлорид свинца (II), в кипящей воде хлорид свинца (II) PbCl2 полностью растворяется; в концентрированной соляной кислоте заметно растворим в результате реакции:
PbCl2↓ + 2HCl ® H2[PbCl4]
Осадок хлоридов отделяют от раствора центрифугированием.
Для растворения AgCl и отделения Ag+, а также открытия H g22+ к осадку хлоридов приливают концентрированный раствор аммиака, перемешивают, центрифугируют. Протекают реакции:
AgCl¯ + 2NH4OH ® [Ag(NH3)2]Cl + 2H2O
Hg2Cl2¯ + 2NH4OH ® [Hg2NH2]Cl↓ + 2H2O + NH4Cl
Амидное соединение ртути (I) неустойчиво и диспропорционирует на амидное соединение ртути (II) и металлическую ртуть, которую легко заметить по появлению черного осадка:
[Hg2NH2]Cl↓ ® Hg¯ + [HgNH2]Cl¯
чёрный белый
Хлорид свинца (II) переходит в менее растворимый осадок гидроксида свинца (II):
PbCl2¯ +2NH4OH ® Pb(OH)2¯ +2NH4Cl:
белый белый
- если образующийся осадок хлоридов при действии аммиака почернел, значит, в исходной смеси присутствует ион ртути (I);
- если при прибавлении NH4OH к осадку хлоридов он остался белым, значит, иона ртути нет, а в нерастворившемся осадке — гидроксид свинца (II);
- если при добавлении NH4OH к осадку хлоридов он полностью растворился, значит, в смеси отсутствуют ионы и ртути (I), и свинца (II), а ион серебра полностью перешёл в раствор.
|
|
|
Для обнаружения Ag+ после центрифугирования полученный раствор хлорида диаминсеребра (I) [Ag(NH3)2]Cl делят пополам.
1. В первую пробирку прибавляют по каплям HNO3 до рН < 5; в присутствии ионов серебра выпадает белый осадок:
[Ag(NH3)2]Cl + 2HNO3 ® AgCl¯ + 2NH4NO3;
В ходе систематического анализа при последовательном добавлении нескольких реактивов анализируемый раствор разбавляется. Из разбавленных растворов образуется коллоидный раствор AgCl, в котором заметно помутнение и появление голубоватой опалесценции.
2. Во вторую пробирку приливают раствор KI, в присутствии Ag+ выпадает желтоватый осадок AgI:
[Ag(NH3)2]Cl + KI + 2H2O ® AgI¯ + 2NH4OH + KCl
жёлтоватый
Для отделения и растворения Pb (OH)2 к осадку, полученному после действия аммиака на хлориды (Hg+[HgNH2]Cl+Pb(OH)2), прибавляют 8-10 капель концентрированного раствора NaOH до рН>10, перемешивают стеклянной палочкой, центрифугируют, раствор сливают в чистую пробирку. Протекает реакция
Pb(OH)2¯ + 2NaOH ® Na2[Pb(OH)4]
Для обнаружения Pb2+ к полученному раствору тетрагидроксоплюмбата (II) натрия Na2[Pb(OH)4] прибавляют несколько капель раствора K2CrO4 и 2н HNO3 до рН≈5. Выпадение жёлтого осадка PbCrO4 указывает на наличие иона свинца:
Na2[Pb(OH)4] + K2CrO4 + 4HNO3 ® PbCrO4¯ + 2KNO3 + 2NaNO3 + 4H2O.
Желтый осадок хромата свинца (II) PbCrO4 (ПРPbCrO4=1,8∙10-14) растворяется как в избытке щелочи, так и в избытке сильной кислоты, но не- растворим в ацетатном буферном растворе. Поэтому очень важно правильно провести его осаждение в слабокислой среде (рН≈5).
Обнаружению Pb2+ в виде желтого осадка PbCrO4 мешают катионы Ag+, Hg22+, Ba2+ и др., которые с хроматом калия образуют окрашенные осадки: Ag2CrO4 — кирпично-красный, Hg2CrO4 — красный, BaCrO4 — желтый. Эти катионы должны быть отделены.
Контрольные вопросы
1.Что является групповым реагентом на катионы 1 аналитической группы?
2. Как проводится дробное растворение хлорида серебра (I)?
|
|
|
3. Особенности обнаружения серебра (I).
4. Особенности реакции обнаружения ртути (I).
5. Как проводится растворение гидроксида свинца (II)?
6. Особенности реакции обнаружения свинца (II).
7. Как различить хромат свинца (II) и хромат бария?
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 314-316.
2. Основы аналитической химии. Практическое руководство /под ред. акад. Ю.А. Золотова — М.: Высшая школа, 2001. — С. 29-35.
А.Т. Чанышева
Лекция 15. Групповые реакции катионов II аналитической группы. Выщелачивание
Ключевые слова: II аналитическая группа, серная кислота, дробное осаждение, выщелачивание.
При систематическом анализе катионов для отделения катионов Ca2+, Sr2+, Bа2+ их осаждают 2н раствором H2SO4, переводя в малорастворимые осадки сульфатов:
Me2+ + SO42- → MeSO4↓
В таблице приведены значения произведений растворимости и растворимость сульфатов Ca2+, Sr2+, Bа2+. Первым осаждается наименее растворимый сульфат бария BаSO4, затем — сульфат стронция SrSO4. Сульфат кальция CaSO4 более растворим, поэтому его осадок выпадает медленно и последним. Для полного осаждения сульфата кальция в раствор добавляют несколько капель этилового спирта.
| Соединение MeSO4 | ПРMeSO4 | Растворимость MeSO4, S, моль/л | Соединение MeCO3 | ПРMeCO3 | Кравн |
| CaSO4 | 9,1∙10-6 | 5,00∙10-3 | CaCO3 | 4,8∙10-9 | 1,9∙103 |
| SrSO4 | 3,2∙10-7 | 5,66∙10-4 | SrCO3 | 1,1∙10-10 | 2,9∙103 |
| BаSO4 | 1,1∙10-10 | 1,05∙10-5 | BaCO3 | 5,1∙10-9 | 2,1∙10-2 |
Сульфаты CaSO4, SrSO4, BаSO4 являются солями сильной кислоты и сильных оснований, они не растворяются ни в кислотах, ни в щелочах, ни в растворе аммиака или других каких-либо растворах. Поэтому для перевода катионов Ca2+, Sr2+, Bа2+ в раствор и проведения качественных реакций обнаружения, сульфаты переводят в карбонаты — соли слабой угольной кислоты, растворимые в уксусной кислоте.
Для перевода в раствор катионов Ca2+, Sr2+, Bа2+ (Ме2+) осадок смеси сульфатов обрабатывают при нагревании насыщенным кипящим раствором соды — Na2CO3. Процесс перевода сульфатов в карбонаты называется «выщелачиванием». Рассмотрим процесс выщелачивания подробнее:
МеSO4 ↓ + Na2CO3  МеСO3↓ + Na2SO4
МеСO3↓ + Na2SO4
МеSO4 ↓ + CO32-  МеСO3↓ + SO42-
МеСO3↓ + SO42-
Кравн =  =
=  =
= 
Значения Кравн приведены в таблице. Очевидно, что сульфаты кальция и стронция легко превращаются в карбонаты, так как Кравн > 1.
Равновесие взаимодействия сульфата бария с Na2CO3 смещено влево, в сторону образования BаSO4.
BаSO4↓ + Na2CO3  BаСO3↓ + Na2SO4,
BаСO3↓ + Na2SO4,
BаSO4↓ + CO32-  BаСO3↓ + SO42-, Кравн = 2,1∙10-2 < 1
BаСO3↓ + SO42-, Кравн = 2,1∙10-2 < 1
Рассчитаем избыточную концетрацию CO32--ионов, необходимую для смещения равновесия в сторону образования BаСO3.
|
|
|
Осадок BаСO3 образуется из перенасыщенного раствора при условии
ПК = [Ba2+]∙[CO32-] >ПРBaCO3= 5,1∙10-9 или [Ba2+] > 
Но концентрация ионов Ba2+ в насыщенном растворе определяется растворимостью BаSO4 и равна: [Ba2+] =  .
.
При сопоставлении этого с приведенным выше неравенством превращение BаSO4 в BaCO3 должно происходить при условии:
 >
>  или
или  >
>  =
=  = 46,4
= 46,4
Чтобы происходило превращение BаSO4 в BaCO3, концентрация ионов CO32- в растворе должна превышать концентрацию ионов SO42- более чем в 46,4 раза, а так как последняя очень мала (1,05∙10-5 моль/л), это условие легко выполнимо.
Операцию выщелачивания повторяют несколько раз, добавляя к осадку сульфатов свежие порции насыщенного раствора Na2CO3. Для повышения скорости реакции смесь кипятят. После центрифугирования удаляют раствор, в котором накапливаются ионы SO42-. Смесь карбонатов должна быть полностью отмыта от SO42- -ионов, иначе при добавлении кислоты вновь в осадок выпадут сульфаты. Выщелачивание прекращают, если центрифугат не дает осадка при действии на подкисленный раствор (pH≈2) хлорида бария BaCl2.
Образовавшуюся нерастворимую в воде смесь карбонатов после центрифугирования растворяют в уксусной кислоте:
МеСO3↓ + 2CH3COOН → Ме2+ + СО2↑ + Н2О + 2CH3COO-
Перешедшие в раствор катионы кальция, стронция и бария открывают специфическими реакциями обнаружения.
Контрольные вопросы
1. В какой последовательности и почему выпадают в осадок сульфаты Ca2+, Sr2+, Bа2+?
2. Какие свойства проявляют сульфаты Ca2+, Sr2+, Bа2+?
3. В чем можно растворить сульфаты Ca2+, Sr2+, Bа2+?
3. Что такое выщелачивание и как его проводят?
4. Для чего проводят выщелачивание?
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 321, 362-371.
2. Хаханина Т.И., Никитина Н.Г. Аналитическая химия: учеб. пособие. — М.: ЮРАЙТ; Высш. образ.,2010. — С. 59-68.
А.Т. Чанышева
Лекция 16. Анализ смеси катионов II аналитической группы. Реакции обнаружения
Ключевые слова: II аналитическая группа, дробное осаждение, реакции обнаружения катионов кальция, стронция, бария
Специфичной реакцией обнаружения катионов кальция является микрокристаллоскопическая реакция, которую можно провести дробным способом. Для этого к четырем каплям исследуемого раствора необходимо добавить 4-5 капель разбавленной H2SO4, центрифугировать. Одну каплю центрифугата поместить на предметное стекло и после появления по периметру капли кристаллов рассмотреть их под микроскопом. Образующиеся кристаллы гипса CaSO4∙2H2O имеют характерную игольчатую форму, напоминающую снежинки (рисунок).

Кристаллы гипса CaSO4∙2H2O
Для обнаружения стронция используют избыток насыщенного раствора (NH4)2SO4. В присутствии Sr2+ выпадает белый осадок SrSO4:
Sr2+ + SO42- ® SrSO4¯.
Ионы кальция в избытке насыщенного раствора (NH4)2SO4 образуют неустойчивый комплекс и не мешают открытию стронция:
Ca2+ + 2SO42- → [Ca(SO4)2]2-
Следует иметь в виду, что сульфат стронция SrSO4 образует перенасыщенные растворы, из которых SrSO4 выделяется только при кипячении, энергичном встряхивании и продолжительном отстаивании после охлаждения.
Однако в присутствии ионов бария определение стронция не- специфично и невозможно, так как в первую очередь выпадает осадок сульфата бария. Поэтому в анализе смеси катионов II аналитической группы необходимо прежде всего провести обнаружение и затем отделение катионов бария.
Для этого проводят дробное осаждение желтого осадка хромата бария действием дихромата калия в присутствии ацетатного буферного раствора.
В водном растворе K2Cr2O7 устанавливается равновесие
Cr2O72- + H2O  2CrO42− + 2Н+.
2CrO42− + 2Н+.
При добавлении кислоты равновесие смещается влево, в сторону образования Cr2O72--ионов, в щелочной среде — в сторону образования CrO42- -ионов. Таким образом, в растворе дихромата калия присутствуют как Cr2O72--ионы, так и CrO42--ионы.
Первым выпадает осадок, по отношению к которому раньше образуется перенасыщенный раствор и выполняется условие: ПК > ПР. Хромат бария BаCrO4 менее растворим в воде, чем дихромат бария BаCr2O7, поскольку ПРBаCrO4=2,4∙10-10 < ПРBаCr2O7=1,2∙10-9. Поэтому при действии дихромата калия в осадок выпадает BаCrO4, а не BаCr2O7. Так как хромат-ионы связываются в осадок BaCrO4 равновесие гидролиза дихромат-ионов смещается вправо, в сторону дополнительного образования хромат-ионов и происходит образование осадка BaCrO4 по реакции
2Ва2+ + Cr2O72- + H2O  2BаCrO4 ↓ + 2Н+
2BаCrO4 ↓ + 2Н+
Одним из продуктов этой реакции является сильная кислота (Н+), в которой хромат бария может растворяться. Для нейтрализации ионов Н+ в раствор добавляют ацетат натрия CН3СООNа. Ацетат-ионы связывают ионы водорода в слабую уксусную кислоту CН3СООН, при этом равновесие смещается вправо. Ацетат натрия необходим в избытке, для получения ацетатной буферной смеси (CН3СОО−+CН3СООН), которая поддерживает практически постоянным значение рН≈4-5. В этих условиях происходит полное осаждение BаCrO4, поскольку в уксусной кислоте он не растворяется.
2Ва2+ + Cr2O72- + 2CН3СОО− + H2O → 2BаCrO4↓ + 2CН3СООН
Обнаружение иона Ba2+ действием дихромата калия с образованием желтого осадка BaCrO4 является специфичной только при проведении ее в ацетатном буферном растворе (рН≈4-5). Поскольку в нейтральной среде (рН≈7) одновременно выпадает осадок хромата стронция SrCrO4, а в сильно щелочной (рН>7) — и хромата кальция CaCrO4. Таким образом, изменяя рН раствора, можно провести дробное осаждение хроматов катионов Са2+, Sr2+ и Ba2+.
Если ион бария отсутствует, то реакцию обнаружения стронция можно выполнять с исходным раствором. Если открыт ион бария, то ко всему исходному раствору добавляют ацетат натрия, дихромат калия до оранжевой окраски раствора над желтым осадком, нагревают, центрифугируют. Осадок BaCrO4 не исследуется, а раствор содержит ионы стронция, кальция и дихромат ионы. Для удаления избытка Cr2O72- –ионов кальций и стронций осаждают в виде карбонатов, центрифугируют, промывают и растворяют в кислоте, в растворе открывают Sr2+ реакцией с насыщенным раствором (NH4)2SO4.
Контрольные вопросы
1. Реакция обнаружения Са2+.
2. Реакция обнаружения Sr2+, в каких условиях она специфична?
3. Особенности реакции обнаружения и отделения Ba2+.
4. Почему при действии дихромата в осадок выпадает хромат бария?
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 327-328, 362-371.
2. Хаханина Т.И., Никитина Н.Г. Аналитическая химия: учеб. пособие. — М.: ЮРАЙТ; Высш. образ.,2010. — С. 59-68.
А.Т. Чанышева
Лекция 17. Анализ смеси катионов III аналитической группы. Амфотерность
Ключевые слова: амфотерные гидроксиды, кислотные свойства, основные свойства, соосаждение, реакции обнаружения катионов алюминия, хрома(III), цинка.
При анализе катионов кислотно-основным методом в III аналитическую группувходят Аl3+, Cr3+, Zn2+, гидроксиды этих катионов проявляют амфотерные свойства. Амфотерными называют гидроксиды, проявляющие и кислотные, и основные свойства, а само явление – амфотерностью. Амфотерными свойствами обладают гидроксиды Al(OH)3, Cr(OH)3, Zn(OH)2, Sn(OH)2, Pb(OH)2, As(OH)3 и некоторые другие. Все они плохо растворимы в воде. Частично растворяясь, амфотерные гидроксиды могут диссоциировать на ионы двумя способами:
1 2
[Zn(OH)4]2- + 2H+  2 H2O + Zn(OH)2↓
2 H2O + Zn(OH)2↓  Zn2+ + 2OH-
Zn2+ + 2OH-
При добавлении основания, то есть ионов OH-, связываются ионы H+ и раствор становится ненасыщенным относительно Zn(OH)2, что приводит к растворению осадка и накоплению тетрагидроксоцинката [Zn(OH)4]2-, то есть равновесие смещается влево. Если добавлять кислоту, то связываются ионы OH-, что сопровождается растворением осадка с образованием катионов Zn2+, и равновесие смещается вправо. Следовательно, в кислых растворах присутствуют катионы Zn2+ (гидратированные ионы [Zn(H2O)4]2+), а в щелочных — анионы [Zn(OH)4]2-.
При любых условиях в растворе амфотерного гидроксида должны присутствовать и катионы [ Me (H 2 O)6] n +, и анионы [ Me (OH)4] n -4, отношение между их концентрациями определяется концентрацией H + в растворе.
Существуют две константы равновесия, характеризующие амфотерный гидроксид, − для диссоциации по типу основания: Косн=  = 1,5∙10−9 и по типу кислоты: Ккисл=
= 1,5∙10−9 и по типу кислоты: Ккисл=  = 7,1∙10−12
= 7,1∙10−12
Первая константа больше, чем вторая: Косн > Ккисл. Следовательно, у гидроксида цинка кислотные свойства выражены слабее, чем основные. Все сказанное о Zn(OH)2 применимо и к другим амфотерным гидроксидам.
При взаимодействии с кислотами проявляются основные свойства гидроксида. Амфотерные гидроксиды растворяются в кислотах с образованием солей:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O
Zn(OH)2 + 2H+ → Zn2+ + 2H2O
Кислотные свойства амфотерного гидроксида проявляются в том, что он легко растворяется в водных растворах щелочей с образованием гидроксокомплексов:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
Zn(OH)2 + 2OH- → [Zn(OH)4]2-
Групповым реагентом на катионы III аналитической группы является раствор щёлочи, при действии избытка которого образуются растворимые в воде гидроксокомплексы. Таким способом Аl3+, Cr3+, Zn2+ можно отделить от катионов IV и V аналитической группы.
Многие соли амфотерных гидроксидов, как и гидроксиды, растворяются в избытке концентрированного раствора щелочи, например:
AlPO4↓ + 4OH- → [Al(OH)4]- + PO43-
Анализ смеси катионов III аналитической группы можно провести дробным способом.
Обнаружение хрома капельной реакцией с бензидином. Уксусно-кислый раствор бензидина C12H8(NH2)2 окисляется ионами CrO42- в соединение синего цвета. Реакция выполняется капельным методом после окисления Cr3+ в CrO42- действием перекиси водорода в щелочной среде. К 2-3 каплям исследуемого раствора прибавляют концентрированный раствор NaOH до растворения выпавшего осадка Cr(OH)3 и образования раствора [Cr(OH)4]- зелёного цвета. После чего приливают 3-4 капли перекиси водорода и нагревают, пока окраска из зелёной не станет жёлтой в результате образования хромата по реакции:
2CrCl3 + 10 NaOH + 3H2O2 ® 2Na2CrO4 + 8H2O + 6NaCl
На полоску фильтровальной бумаги наносят каплю полученного раствора хромата и каплю бензидина. Пятно синеет.
Бензидин является индикатором на окислители, с которыми дает синее окрашивание. Перекись водорода проявляет окислительные свойства, чтобы не «переоткрыть» Cr3+, ее необходимо полностью удалить из раствора. Смесь кипятят до полного разложения перекиси водорода и прекращения выделения газообразного O2 по реакции 2H2O2 ® 2H2O + O2.
Обнаружение алюминия реакцией с алюминоном. Алюминон C22H11O3(NH4)3 при рН≈5 образует с Al3+ комплексное соединение малинового цвета, по структуре подобное «лаку». К 2 каплям исследуемого раствора прибавляют 2н раствор СН3СООН до рН≈5, приливают 2 капли раствора алюминона и нагревают на водяной бане, затем прибавляют раствор NH4OH (до запаха), 2-3 капли раствора (NH4)2СO3 и кипятят. Красные хлопья алюминиевого лака доказывают присутствие Al3+. Если раствор соли Al3+ очень разбавленный, осадок не выпадает, но окраска раствора становится ярко- малиновой. В этом случае рекомендуется провести «холостой опыт» — смешать реактивы без соли или исследуемого раствора — и сравнить окраски растворов. Ярко-малиновая окраска анализируемого раствора свидетельствует о присутствии Al3+.
Обнаружение Al3+ с помощью алюминона проводят в присутствии ацетатного буферного раствора (рН≈5). Если не создать необходимое значение рН раствора, то в кислой среде можно «переоткрыть» алюминий, а в щелочной «недооткрыть», так как реакция не идет. Реакция образования «алюминиевого лака» идет медленно, при нагревании окраска появляется быстрее.
Обнаружению Al3+ с алюминоном мешают катионы Fe2+, Cr3+, Ca2+, Pb2+, Mn2+ и некоторые другие. Ионы Fe2+ образуют коричневое соединение, Cr3+, Ca2+ и Pb2+ также как и Al3+ — красного цвета. Мешающие ионы необходимо устранить групповыми реагентами; Ca2+ удаляют из раствора кипячением с (NH4)2CO3 и NH4OH. Для устранения Cr3+ его полностью окисляют до хромат-иона, ионы CrO42- открытию Al3+ с алюминоном не мешают.
Обнаружение цинка реакцией с тетрароданогидраргиратом(II) аммония ((NH4)2[Hg(SCN)4]) основано на соосаждении с солью кобальта (II): и Zn2+ и Co2+ образуют осадки:
[Hg(SCN)4]2- + Zn2+ → Zn[Hg(SCN)4]↓
белый
[Hg(SCN)4]2- + Co2+ → Co[Hg(SCN)4]↓
синий
Из концентрированных растворов солей кобальта осадок образуется быстро, из очень разбавленных растворов (0,02%) он не должен выпасть даже при перемешивании стеклянной палочкой, так как раствор ненасыщенный. Добавление к нему раствора соли цинка вызывает моментальное выпадение голубого осадка, представляющего собой смешанные кристаллы. Образующийся белый осадок Zn[Hg(SCN)4] ускоряет, как затравка, выпадение синего осадка Co[Hg(SCN)4] и получение смешанных кристаллов.
Обнаружению Zn2+ этой реакцией мешают большие количества соли Co2+, присутствие Fe2+, Fe3+, Ni2+, Cu2+, которые также дают окрашенные осадки с тетрароданогидраргиратом (II) аммония. Их предварительно удаляют, осаждая в виде гидроксидов действием раствора NaOH и перекиси водорода.
Если анализируемый раствор имеет щелочную среду, его подкисляют до рН≈5. К 2-3 каплям (NH4)2[Hg(SCN)4] прибавляют 1 каплю раствора CoCl2 (0,02%) и потирают стеклянной палочкой о стенки пробирки. Следует убедиться, что осадок не образуется. После чего добавляют 1 каплю исследуемого раствора и вновь потирают стеклянной палочкой о стенки пробирки. В присутствии иона Zn2+ быстро выпадет голубой осадок, состоящий из голубого Co[Hg(SCN)4] и белого Zn[Hg(SCN)4].
Контрольные вопросы
1. Какие свойства проявляют амфотерные гидроксиды?
2. Особенности реакции обнаружения Cr3+.
3. Особенности реакции обнаружения Al3+.
4. Особенности реакции обнаружения Zn2+.
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001. – С. 372-377, 380-383.
2. Основы аналитической химии. Практическое руководство /под ред. акад. Ю.А. Золотова — М.: Высшая школа, 2001. — С. 36-42, 47-49.
А.Т.Чанышева, О.Б.Чалова
Лекция 18. Групповые реакции катионов IV аналитической группы. Избирательное растворение
Ключевые слова: IV аналитическая группа, гидроксид, рН начала осаждения, рН полного осаждения, избирательное растворение.
В четвёртой гидроксидной группе катионов изучаются ионы Fe2+, Fe3+, Mn2+, Mg2+, Bi3+. Групповыми реагентами являются растворы аммиака или щёлочи, которые осаждают эти ионы в виде гидроксидов, нерастворимых в избытке реактивов. Все гидроксиды IV аналитической группы имеют основные свойства: Mg(OH)2, Мn(ОН)2, Fe(OH)2 — основания средней силы, Вi(ОН)3 , Fe(OH)3 — очень слабые основания.
В ходе анализа катионов IV аналитической группы ионы Fe2+, Fe3+, Mn2+, Bi3+открываются дробно, а Mg2+ — после его дробного избирательного растворения из осадка гидроксидов с дальнейшим отделением и обнаружением.
Осаждение трудно растворимых гидроксидов катионов IV аналитической группы. Осаждающим ионом является ион ОН−
Men+ + nOH- → Me(OH)n↓
От концентрации ионов ОН− зависит, выпадет ли осадок гидроксида и будет ли осаждение практически полным. Чем более растворим гидроксид, тем большая концентрация ионов ОН− необходима для превышения величины ПР гидроксида, тем большая величина рН потребуется для начала его осаждения. Концентрация ионов ОН− тем больше, чем больше рН раствора.
Осадок гидроксида образуется, если ПК ≥ ПР. Исходя из величины ПР, можно приблизительно вычислить, при каком рН начинается и заканчивается осаждение гидроксида. Вычислим рН начала осаждения и рН полного осаждения для гидроксида магния (ПРMg(OH)2=5·10-12). Если концентрация иона Mg2+ в растворе 1·10-2моль/л, то из уравнения
ПРMg(OH)2 = [Mg2+]∙[OH-]2 =5·10-12
можно вычислить концентрацию ионов ОН−, при которой достигается величина ПР и начинается осаждение Mg(OH)2. Она равна
[OH-](начала осаждения) = 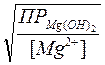 =
=  = 2,2∙10−5 моль∕л
= 2,2∙10−5 моль∕л
Следовательно: рОН = −lg 2,2∙10−5 =4,7, а рН(начала осаждения)=14−рОН=14−4,7= 9,3. Осаждение Mg(OH)2 из 0,01 М раствора его соли начинается при рН=9,3.
Полным осаждением какого-либо иона можно считать, если концентрация его в растворе понижается до 10-6 моль/л. Учитывая это, получим
[OH-](полного осаждения)= 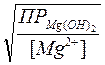 =
=  = 2,2∙10−3 моль∕л
= 2,2∙10−3 моль∕л
Следовательно, рОН=2,7 и рН(полного осаждения)=11,3.
Если рН≥11,3, то осаждение Mg2+будет полным. Наоборот, при рН<11,3 — неполным, а при рН<9,3 оно не будет происходить.
Произведя подобные вычисления для менее растворимого Fе(OH)3
(ПР=3,8·10-38), найдем, что осаждение Fе(OH)3 из 0,01М раствора соли железа (III) начинается при рН=2,3 и становится практически полным при рН≥3,5.
В таблице приводятся результаты аналогичных вычислений рН для малорастворимых гидроксидов IV аналитической группы.
| Гидроксид | ПР | рН начала осаждения при концентрации иона, равной | рН полного осаждения при [Me2+] = 10-6M | |
| 1 М | 0,01 М | |||
| Mg(OH)2 | 5,0∙10−12 | 9,4 | 10,4 | 11,3 |
| Мn(ОН)2 | 4,0∙10−14 | 7,8 | 8,8 | 10,4 |
| Fe(OH)2 | 4,8∙10−16 | 6,5 | 7,5 | 9,7 |
| Вi(ОН)3 | 4,3∙10−31 | 3,8 | 4,5 | 5,8 |
| Fe(OH)3 | 3,8∙10−38 | 1,5 | 2,3 | 3,5 |
Близкими интервалами значений рН начала и полного осаждения характеризуются гидроксиды Mg(OH)2, Мn(ОН)2, Fe(OH)2, тогда как гидроксиды Вi(ОН)3 , Fe(OH)3 осаждаются полностью даже в кислой среде. Таким образом, контролируя и поддерживая рН можно разделить эти две группы гидроксидов.
Рассмотрим осаждение гидроксидов действием раствора аммиака. Так как рН 0,1 М раствора NH4OH равен 11,3, то его избыток должен осаждать ионы Mg2+, например
MgCl2 + 2NH4OH → Mg(OH)2 + 2NH4Cl
В результате реакции образуется соль аммония. Для полученной аммиачной (NH4OH+NH4Cl) буферной смеси рН можно вычислить по формуле
рН=14−рК(осн.)+lg(C(осн.)/С(соли)) = 14−4,75+lg(0,1/0,1)= 9,25.
Следовательно при действии аммиачной ([NH4OH]:[NH4Cl] = 1:1) буферной смеси осадок Mg(OH)2 не выпадает, осадки Мn(ОН)2, Fe(OH)2 растворяются частично. Таким образом, для избирательного растворения Mg(OH)2 необходимо устранить мешающие соединения Мn(ОН)2, Fe(OH)2. Для этого их окисляют перекисью водорода до соединений MnO2 и Fe(OH)3:
Мn(ОН)2 + H2O2 → MnO2↓ + 2H2O
2Fe(OH)2 + H2O2 → 2Fe(OH)3↓
Осадки MnO2 и Fe(OH)3 характеризуются очень низ
|
|
|


