 |
Молекулярно-кинетической теории
|
|
|
|
1. Основное уравнение молекулярно-кинетической теории газов

где р – давление газа; n – концентрация молекул; m0 – масса молекулы; < υ2 > – средний квадрат скорости поступательного движения молекулы; ρ – плотность; < εк > – средняя кинетическая энергия поступательного движения молекулы.
2. Закон равномерного распределения энергии по степеням свободы: на каждую степень свободы поступательного и вращательного движения молекулы приходится средняя энергия  .
.
3. Средняя энергия молекулы газа  ,
,
где i – число степеней свободы молекулы.
4. Скорости молекул газа:
 – среднеквадратичная скорость;
– среднеквадратичная скорость;
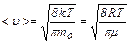 – средняя арифметическая скорость;
– средняя арифметическая скорость;
 – наиболее вероятная скорость.
– наиболее вероятная скорость.
5. Функция распределения Максвелла
 .
.
6. Распределение Больцмана
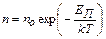 ,
,
где n – концентрация молекул с потенциальной энергией EП;
n0 – концентрация молекул с потенциальной энергией EП=0;
EП – потенциальная энергия молекулы.
Примеры решения задач
Задача 1. При давлении газа, равном 0,1 МПа, его двухатомные молекулы обладают средней кинетической энергией 2,5·10-20 Дж. Определить концентрацию молекул газа.
 Дано: Решение:
Дано: Решение:
i = 5 Воспользуемся основным уравне-
р = 1·105 Па нием молекулярно-кинетической
 <εк>= 2,5·10-20 Дж теории газов:
<εк>= 2,5·10-20 Дж теории газов:
 . (1)
. (1)
n –? Так как средняя кинетическая энергия поступательного движения молекулы  , а средняя энергия молекулы, включая кинетическую энергию вращательного движения,
, а средняя энергия молекулы, включая кинетическую энергию вращательного движения,
 ,
,
то с учетом закона равномерного распределения энергии по степеням свободы для <ε> получаем
 . (2)
. (2)
Используя формулы (1) и (2), находим
 .
.
Проверка размерности:
 .
.
Вычисления:
 .
.
Ответ: 1,0·1025 м-3.
Задача 2. Определить наиболее вероятную скорость, среднюю арифметическую скорость и среднюю квадратичную скорость молекул газа, у которого при нормальном атмосферном давлении плотность равна 0,3 кг/м3.
|
|
|
 Дано: Решение:
Дано: Решение:
р = 105 Па Для нахождения искомых скоростей
ρ = 0,3 кг/м3 воспользуемся формулами их определений.

 При этом параметры (температуру и молярную массу), входящие в эти формулы, выразим из уравнения состояния идеального газа
При этом параметры (температуру и молярную массу), входящие в эти формулы, выразим из уравнения состояния идеального газа  .
.
Таким образом, получаем
 – наиболее вероятная скорость;
– наиболее вероятная скорость;
 – средняя арифметическая скорость;
– средняя арифметическая скорость;
 – средняя квадратичная скорость.
– средняя квадратичная скорость.
Проверка размерности:

 .
.
Вычисления:
 ;
;
 ;
;
 .
.
Ответ:  ,
,  ,
,  .
.
Задача 3. Определить наиболее вероятную скорость молекул газа, находящегося в состоянии теплового равновесия, при котором значениям скоростей молекул 300 м/с и 600 м/с соответствуют одинаковые значения функции распределения Максвелла.
 Дано: Решение:
Дано: Решение:
υ1 = 300 м/с Функция распределения Максвелла:
υ2 = 600 м/с


 .
.
Учитывая выражение для определения наиболее вероятной скорости
 ,
,
получаем функцию распределения Максвелла в следующем виде:
 .
.
Применив полученное выражение для двух значений скоростей, с учетом условия задачи  получаем
получаем
 .
.
Логарифмируем и выражаем искомую величину.
 .
.
Соответствие размерности очевидно.
Вычисления: 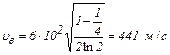 .
.
Ответ: 441 м/с.
Задача 4. При наблюдении в микроскоп взвешенных в жидкости частиц гуммигута обнаружено, что концентрация частиц в одной фокальной плоскости в два раза больше их концентрации в другой фокальной плоскости, расстояние между которыми 40 мкм. Температура жидкости 17 °С. Диаметр частиц 0,4 мкм, а плотность гуммигута на 0,2 г/см3 больше плотности окружающей жидкости. Определить по этим данным число Авогадро.
Дано: Решение:
 ∆h = 40 мкм = 4 ·10-5 м Распределение частиц, взвешенных
∆h = 40 мкм = 4 ·10-5 м Распределение частиц, взвешенных
 в жидкости, подчиняется закону
в жидкости, подчиняется закону
Т = 17 °С = 290 К Больцмана:
d = 0,4 мкм = 4·10-7 м 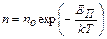 . (1)
. (1)

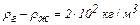

Поле тяжести Земли в пределах рассматриваемых изменений высоты можно считать однородным. Если учесть, что частицы гуммигута испытывают действие выталкивающей силы Архимеда
|
|
|
 , (2)
, (2)
где V – объем частицы, то для потенциальной энергии частицы следует записать

Концентрации частиц в фокальных плоскостях на высотах h1 и h2, отсчитанных от дна сосуда, согласно уравнению (1), равны
 ,
,
 .
.
Найдем отношение
 . (3)
. (3)
Учитывая, что  ,
, 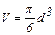 , ∆h = h1 – h2, из (3) находим
, ∆h = h1 – h2, из (3) находим
 .
.
Проверка размерности:  .
.
Вычисления:
 .
.
Ответ: 6,4·1023 1/моль.
|
|
|


