 |
Модель атома Бора, ее недостатки. Постулаты Бора. Энергетические уровни атома водорода и его спектр по модели Резерфорда – Бора.
|
|
|
|
 Модель планетарная (ядерная) + постулаты Бора
Модель планетарная (ядерная) + постулаты Бора
1. Специальные состояния: Е1, Е2, Е3, … - уровни энергии.
2. Момент импульса: 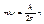 , n =1,2,3,…– номер стационарного состояния, орбиты.
, n =1,2,3,…– номер стационарного состояния, орбиты.
(волна де Бройля:  , 2 πr=λn – Бор не знал!)
, 2 πr=λn – Бор не знал!)
3. n,k – номера уровней энергии
hν = Еn - Ek – Энергия излучается скачком, при переходе с одного энергетического уровня на другой n→k.
Схема расчета:
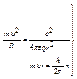 rn, υn
rn, υn
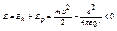 - характер притяжения
- характер притяжения
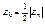
Eп – полная энергия на уровне с номером n: 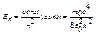
Модель Бора позволяет рассчитать стационарные состояния атома водорода: rn, υn, Еn. Кулоновская сила притяжения электрона к ядру сообщает электрону центростремительное ускорение: 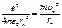 . Это уравнение, решенное совместно с уравнением (6.2), дает rn и υn. Полная энергия электрона в стационарном состоянии отрицательная, так как потенциальная энергия кулоновского притяжения
. Это уравнение, решенное совместно с уравнением (6.2), дает rn и υn. Полная энергия электрона в стационарном состоянии отрицательная, так как потенциальная энергия кулоновского притяжения  отрицательная и превосходит по модулю кинетическую энергию, иначе бы электрон покинул атом. Расчеты дают следующую формулу:
отрицательная и превосходит по модулю кинетическую энергию, иначе бы электрон покинул атом. Расчеты дают следующую формулу:

Модель Бора дала правильный результат для спектра водородоподобных ионов, т.е. ионизованных атомов, где остался всего лишь один электрон: 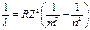 . Z -порядковый номер элемента в таблице Менделеева, указывающий величину заряда ядра иона.
. Z -порядковый номер элемента в таблице Менделеева, указывающий величину заряда ядра иона.
Однако для атомов, содержащих два и более электронов, теория Бора не совпала с опытом. В современной физике модель атома Бора имеет исторический характер. Эта модель не является последовательно ни классической, ни квантовой. Ее историческая роль состоит в том, что она показала, что атом – микрочастица, и является объектом квантовой физики. Современная модель атома – квантовая (или волновая.).
Схема уровней энергий атома водорода (представлена на рис.):
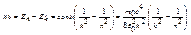 - Теория.
- Теория.
|
|
|
Опыт: формула Бальмера: 
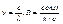 Полное совпадение опыта и теории!
Полное совпадение опыта и теории!
Модель Бора отлично согласуется с опытом для одноэлектронных атомных систем.
атом Н, водородоподобные ионы: He+; Li++.
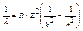 , где Z – порядковый номер элемента (заряд ядра); R – постоянная Ридберга.
, где Z – порядковый номер элемента (заряд ядра); R – постоянная Ридберга.
Однако, для двухэлектронных и более сложных атомов теория Бора не работает. Эта теория приближенная.
Заслуга теории Бора заключается в том, что она показала необходимость перехода от классических к квантовых представлениям. Сама модель Бора была полуклассической, полуквантовой. В настоящее время имеет только исторический интерес.
 Постулаты Бора:
Постулаты Бора:
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии.
mυnrn= 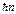
 Здесь m- масса электрона, υn – его скорость при движении по орбите радиуса rn, n – номер стационарной орбиты, n =1, 2,..¥,
Здесь m- масса электрона, υn – его скорость при движении по орбите радиуса rn, n – номер стационарной орбиты, n =1, 2,..¥,  - постоянная Планка. Каждому стационарному состоянию соответствует определенное значение энергии: Е 1, Е 2,.., Еn,..– энергия квантуется.
- постоянная Планка. Каждому стационарному состоянию соответствует определенное значение энергии: Е 1, Е 2,.., Еn,..– энергия квантуется.
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией  равной разности энергий соответствующих стационарных состояний (En и Em энергии до и после излучения (поглощения)).
равной разности энергий соответствующих стационарных состояний (En и Em энергии до и после излучения (поглощения)).
Электрон обладает собственным механическим и магнитным моментами. Собственный механический момент называется спин.
Классическая аналогия:
 |
Состояние электрона в атоме: (n, l, m, S).
Периодическая система Менделеева отображает периодичность свойств разных элементов. Объяснение тому дает квантовая механика. Электроны подчиняются принципу Паули.
1. Паули: n, l, m, S – только один электрон.
2. Принцип минимума Е
В многоэлектронных атомах заполнение электронных оболочек идет снизу вверх.
n =1, l =0, m =0, S =±1/2 2 состояния (H, He);
|
|
|
Квантовая механика – основа химии.
28. Волновая модель атома водорода. Квантовые числа, их проявления в опыте. Периодическая таблица элементов Менделеева как отражение квантовых состояний электронов.
Атом Н


Δ – оператор Лапласа
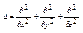
U – сферически-симметричная функция
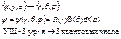
n – главное квантовое число, n = 1,2,3,…,∞ - уровни энергии (квантование энергии)
 (как в модели Бора)
(как в модели Бора)
l – азимутальное (орбитальное) квантовое число; l = 0,1,…, (n -1)
n=1 → l=0
n=2 → l=1,2 и т.д.
Квантование момента импульса:
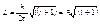 - на одном и том же уровне энергии могут быть электроны с различными моментами импульса.
- на одном и том же уровне энергии могут быть электроны с различными моментами импульса.
m – магнитное квантовое число, связано орбитальным.
m = -l,-(l-1),…, -1, 0, 1,…, l – всего (2 l +1) значение.
Орбитальный момент электрона связан его магнитным моментом (электрон образует круговой ток).
Во внешнем магнитном поле магнитная стрелка стремится повернуть вдоль поля.
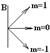 m – проекция Lz, z – ось, заданная внешним полем, например
m – проекция Lz, z – ось, заданная внешним полем, например  .
.
Lz = hm.
Из УШ следует квантование энергии момента импульса и проекции момента импульса, что подтверждается в опыте, т.е. в спектре излучения атома. Квантование энергии – спектр линейчатый; квантование момента импульса и его проекции проявляются в том, что под действием внешнего магнитного поля спектральные линии расщепляются на m -близких линий.
Опыт показал, что даже в отсутствии поля спектральные линии являются дублетами (двойными), что свидетельствует еще об одном квантовом числе S. S = ±1/2 (2 значения). S – спиновое квантовое число.
|
|
|


