 |
Строение и свойства металлов
|
|
|
|
Красноярский институт железнодорожного транспорта
МАТЕРИАЛОВЕДЕНИЕ
КОНСПЕКТ ЛЕКЦИЙ
Составитель В.С.Чекушин
Красноярск 2010
Содержание
1 Общие вопросы материаловедения 3
1.1. Материалы производственного назначения, используемые в изделиях. 3
1.2. Качество материалов и его оценка. 5
1.3. Физические, химические и эксплуатационные свойства материалов. 9
2 Строение и свойства металлов 11
2.1. Дефекты в кристаллах. 14
2.2. Кристаллизация. 16
2.3. Строение металлического слитка. 19
2.4. Аллотропия металлов. 20
2.5. Металлические сплавы.. 21
2.6. Диаграммы состояния сплавов. 27
3 Железо и сплавы на его основе 38
3.1. Система железо — цементит. 39
3.2. Практическое применение диаграммы Fe – Fe3C.. 44
4 Стали 46
5 Чугуны 57
6 Основы теории термической обработки 64
6.1. Четыре основные превращения в сталях. 64
6.2. Закалка и отпуск. 73
6.3. Отжиг и нормализация. 76
6.4. Термическая обработка колес подвижного состава, рельсов, пружин, рессор, подшипников. 81
7 Термомеханическая обработка стали 90
8 Химико-термическая обработка и поверхностное упрочнение стали 91
9 Материал, термообработка, поверхностное упрочнениие, шлифовка и допускаемые напряжения тяговых зубчатых передач 97
Способы поверхностного упрочнения зубьев и шлифовка зубьев. 101
10 Алюминий и сплавы на его основе 106
11 Антифрикционные (подшипниковые) сплавы на оловянной, свинцовой и цинковой основах 110
12 Медь и ее сплавы 113
11.1. Общая характеристика и классификация медных сплавов. 114
11.2. Медно-никелевые сплавы.. 120
13 Порошковые металлические материалы 121
14 Защита металлов от коррозии 131
15 Металлические стекла 133
16 Титан и сплавы на его основе 136
17 Материалы из органических веществ 141
|
|
|
1 Общие вопросы материаловедения
Материаловедение – древнейшая область знаний, обусловленная жизнедеятельностью людей в сферах производства и быта с использованием элементов материального мира неорганической и органической природы с дальнейшими их превращениями и формированием материалов с требуемыми свойствами.
Особенностью цивилизации, в которой мы оказались, являются постоянно растущие потребности в новых типах материалов при постоянно увеличивающихся объемах использования последних.
Материаловед обеспечивает создание технологии получения материалов с заданными свойствами. При этом в современной жизнедеятельности людей, номенклатура необходимых материалов огромна и она постоянно расширяется.
Существенное различие в природе материалов не позволяет обеспечить единообразие в изучении свойств материалов и способах создания материалов с заданными свойствами.
1.1. Материалы производственного назначения, используемые в изделиях

Машиностроительные материалы предназначены для изготовления деталей машин, механизмов и приборов, инструмента, инженерных сооружений и изделий, которые при работе испытывают механические нагрузки, а в некоторых случаях, могут работать под воздействием агрессивной окружающей среды, температуры, трения и других негативных факторов.

|
| Рис. 1.1. Классификация металлических материалов |
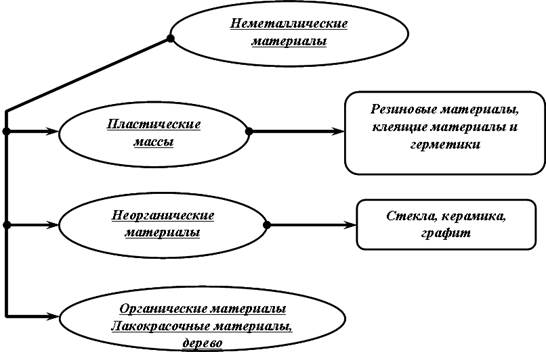
|
| Рис. 1.2. Классификация неметаллических материалов |
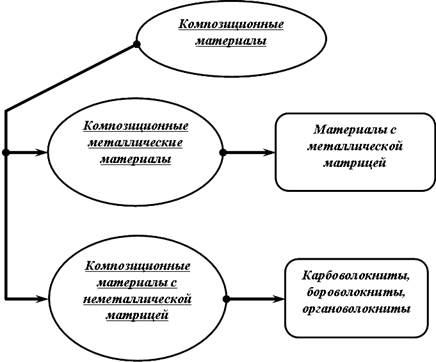
|
| Рис. 1.3. Классификация композиционных материалов |
1.2. Качество материалов и его оценка
Качеством материала называется совокупность его свойств, удовлетворяющих определенные потребности в соответствии с назначением.
Уровень качества определяется показателями, представляющими собой количественную характеристику одного или нескольких свойств материалов, которые определяют их качество применительно к конкретным условиям использования. Показатели качества: единичные и комплексные
|
|
|
Единичный показатель качества характеризуется только одним свойством (например, твердость стали).
Комплексный показатель характеризуется несколькими свойствами материалов (например, стали – химический состав, механические свойства, микро- и макроструктуры). Комплексные показатели качества устанавливаются государственными стандартами.
Качество материала определяется свойствами, химическим составом, структурой. Химический состав может определяться химическим или спектральным анализом. Структура материала определяется макроанализом, микроанализом, рентгеновским анализом, магнитной, ультразвуковой и капиллярной дефектоскопией
Механические свойства материалов
Механические свойства характеризуют способность материалов сопротивляться действию внешних сил.
К основным механическим свойствам относятся прочность, твердость, ударная вязкость, упругость, пластичность, хрупкость и др.
Прочность — способность материала сопротивляться разрушающему воздействию внешних сил.
Твердость — способность материала сопротивляться внедрению в него другого, более твердого тела под действием нагрузки.
Вязкость – свойство материала сопротивляться разрушению под действием динамических нагрузок.
Упругость — свойство материала восстанавливать свои размеры и форму после прекращения действия нагрузки.

|
| Рис. 1.4. К определению прочности, пластичности и хрупкости материала |
Пластичностью называется способность материала изменять свои размеры и форму под действием внешних сил, не разрушаясь при этом.
Хрупкость — свойство материала разрушаться под действием внешних сил без остаточных деформаций.
Величины, характеризующие прочность, пластичность и упругость материала, определяют при статических испытаниях на растяжение. Образец длиной l 0 и диаметром d 0 растягивают под действием приложенной силы Р, до разрушения (рис. 1.4). Внешняя нагрузка вызывает в образце напряжение и деформацию.
Напряжение Ϭ это отношение силы Р к площади поперечного сечения F, МПа:
 (1.1)
(1.1)

Деформация характеризует изменение размеров образца под действием нагрузки, %:
|
|
|
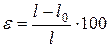 , (1.2)
, (1.2)
где: l – длина растянутого образца.
При испытаниях строится диаграмма растяжения, представляющая собой зависимость напряжения от деформации. На рис.1.5 приведена такая диаграмма для низкоуглеродистой стали.

|
| Рис. 1.5. Диаграмма растяжения |
Предел упругости Ϭу — максимальное напряжение при котором в образце не возникают пластические деформации.
Предел текучести ϬТ — напряжение, соответствующее площадке текучести на диаграмме растяжения. Если на диаграмме нет площадки текучести (что наблюдается для хрупких материалов), то определяют условный предел текучести Ϭ 0,2 — напряжение, вызывающее пластическую деформацию, равную 0,2 %.
Предел прочности (или временное сопротивление) Ϭв — напряжение, отвечающее максимальной нагрузке, которую выдерживает образец при испытании.
Относительное удлинение после разрыва δ – отношение приращения длины образца при растяжении к начальной длине l 0, %:
 (1.3)
(1.3)
где lk — длина образца после разрыва.
Относительным сужением после разрыва ѱ называется уменьшение площади поперечного сечения образца, отнесенное к начальному сечению образца, %:
 , (1.4)
, (1.4)
где Fk — площадь поперечного сечения образца в месте разрыва.
Относительное удлинение и относительное сужение характеризуют пластичность материала. Твердость металлов измеряется путем вдавливания в испытуемый образец твердого наконечника различной формы.
Метод Бринелля основан на вдавливании в поверхность металла стального закаленного шарика под действием определенной нагрузки. После снятия нагрузки в образце остается отпечаток. Число твердости по Бринеллю НВ определяется отношением нагрузки, действующей на шарик, к площади поверхности полученного отпечатка.
Метод Роквелла основан на вдавливании в испытуемый образец закаленного стального шарика диаметром 1,588 мм (шкала В) или алмазного конуса с углом при вершине 120° (шкалы А и С). Вдавливание производится под действием двух нагрузок — предварительной, равной 100 Н и окончательной, равной 600, 1000. 1500 Н для шкал А, В и С соответственно. Число твердости по Роквеллу HRA, HRB и HRC определяется по разности глубин вдавливания.
|
|
|
В методе Виккерса применяют вдавливание алмазной четырехгранной пирамиды с углом при вершине 136°. Число твердости по Виккерсу HV определяется отношением приложенной нагрузки к плошади поверхности отпечатка.
Ударная вязкость определяется работой А, затраченной на разрушение образца, отнесенной к площади его поперечного сечения F; Дж/м2:
 (1.5)
(1.5)
Испытания проводятся ударом специального маятникового копра. Для испытания применяется стандартный надрезанный образец, устанавливаемый на опорах копра. Маятник определенной массы наносит удар по стороне противоположной надрезу.
1.3. Физические, химические и эксплуатационные свойства материалов
К физическим свойствам материалов относится плотность, температура плавления, электропроводность, теплопроводность, магнитные свойства, коэффициент температурного расширения и др.
Плотностью называется отношение массы однородного материала к единице его объема. Это свойство важно при использовании материалов в авиационной и ракетной технике, где создаваемые конструкции должны быть легкими и прочными.
Температура плавления — это такая температура, при которой металл переходит из твердого состояния в жидкое. Чем ниже, температура плавления металла, тем легче протекают процессы его плавления, сварки и тем они дешевле.
Электропроводностью называется способность материала хорошо и без потерь на выделение тепла проводить электрический ток. Хорошей электропроводностью обладают металлы и их сплавы, особенно медь и алюминий. Большинство неметаллических материалов не способны проводить электрический ток, что также является важным свойством, используемом в электроизоляционных материалах.
Теплопроводность — это способность материала переносить теплоту от более нагретых частей тел к менее нагретым. Хорошей теплопроводностью характеризуются металлические материалы.
Магнитными свойствами, т.е. способностью хорошо намагничиваться обладают только железо, никель, кобальт и их сплавы.
Химические свойства характеризуют склонность материалов к взаимодействию с различными веществами и связаны со способностью материалов противостоять вредному действию этих веществ.
Способность металлов и сплавов сопротивляться действию различных агрессивных сред называется коррозионной стойкостью, а аналогичная способность неметаллических материалов — химической стойкостью.
К эксплуатационным (служебным) свойствам относятся жаростойкость, жаропрочность, износостойкость, радиационная стойкость, коррозионная и химическая стойкость и др.
|
|
|
Жаростойкость характеризует способность металлического материала сопротивляться окислению в газовой среде при высокой температуре.
Жаропрочность характеризует способность материала сохранять механические свойства при высокой температуре.
Износостойкость — это способность материала сопротивляться разрушению его поверхностных слоев при трении.
Радиационная стойкость характеризует способность материала сопротивляться действию ядерного облучения.
Вопросы для самоконтроля
1. Материаловедение – это наука или искусство?
2. Как условно подразделяются материалы?
3. Классификация металлических материалов.
4. Классификация неметаллических материалов.
5. Классификация композиционных материалов.
6. Показатели качества материалов.
7. Основные механические свойства материалов и их определение.
8. Сущность статических испытаний материалов на растяжение.
9. Что такое напряжение?
10. Что такое деформация?
11. Что такое предел упругости, предел текучести и предел прочности?
12. Что характеризует относительное удлинение и относительное сужение образца?
13. Методика определения твердости материалов (методы Бринеля, Роквелла, Виккерса). Единицы измерения твердости.
14. Определение ударной вязкости материалов.
Строение и свойства металлов
Металлические материалы делятся на две большие группы: железо и сплавы железа (сталь и чугун) называют черными металлами, а остальные металлы и их сплавы — цветными.
Свойства металлов разнообразны:
· кристаллическое строение в твердом состоянии;
· пластичность и твердость;
· тепло- и электропроводность;
· термоэлектронная эмиссия, т. е. способность к испусканию электронов при нагреве;
· хорошая отражательная способность (металлы практически непрозрачны и имеют характерный металлический блеск).
В элементарном состоянии атомы металлов обладают совокупностью общих и специфических физико-химических свойств, в том числе способностью к взаимодействию с себе подобными атомами металлической природы, а также атомами металлоидной природы.
Металлы, присутствующие в виде расплавленной конденсированной фазы способны выступать в качестве растворителей других металлов и неметаллов (углерода, кислорода, серы и проч.).
Общим свойством металлов в твердом состоянии является формирование совершенных кристаллических структур – кристаллических решеток, в узлах которых расположены атомы, характеризующиеся дефицитом валентных электронов, формирующих электронный газ. В общем виде суммарный положительный заряд ионного остова кристаллического образца нейтрализуется суммарным зарядом электронного газа, концентрация которого зависит от природы атома металла.
Кристаллические тела при нагреве остаются твердыми до определенной температуры (температуры плавления), при которой они переходят в жидкое состояние. Аморфные тела при нагреве размягчаются в большом температурном интервале; сначала они становятся вязкими и лишь, затем переходят в жидкое состояние. Все металлы и их сплавы – тела кристаллические.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Наиболее часто встречаются решетки (рис. 2.1): объемно-центрированная кубическая (OЦK) ‑ α-Fe, Сr, W, гранецентрированная кубическая (ГЦК) ‑ γ-Fe, Al, Сu, гексагональная плотноупакованная (ГПУ)‑ Mg, Zn

|
| Рис. 2.1. Кристаллические решетки железа: а – ОЦК, б – ГЦК, в – ГП; а, b, с – периоды |
В ОЦК решетке центральный атом находится на равноудаленном расстоянии от восьми атомов в вершинах куба. То есть координационное число (К) равно восьми. В ГЦК решетке атом, находящийся в центре грани равноудален от 4 атомов в вершинах куба, от 4 атомов, расположенных на гранях куба и от 4 атомов, принадлежащих контактирующей кристаллической решетке. Таким образом, координационное число равно 12
Степень заполненности объема кристаллической решетки атомами является важной характеристикой структуры. Она определяется такими показателями, как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки (рис. 2.2). Измеряется в нанометрах – нм. 1нм = 10-9 = 10 А. Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а. Для характеристики гексогональной решетки принимаю два параметра – сторону шестигранника – а и высоту призмы – с.

|
| Рис. 2.2. Параметры кристаллической решетки металлов: а, b, с – периоды; α, β, γ – углы |
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексогональной решеткой а находится в пределах 0,228–0,398 нм, а с в пределах 0,357–0,652 нм. Параметры решеток определяются рентгеноструктурным анализом.
2.1. Дефекты в кристаллах
В кристаллах всегда имеются дефекты (несовершенства) строения, обусловленные нарушением правильного расположения атомов кристаллической решетки. Дефекты кристаллического строения подразделяют по геометрическим признакам на точечные, линейные и поверхностные
Большинство атомов данной кристаллической решетки имеют одинаковую (среднюю) энергию и колеблются при данной температуре с одинаковой амплитудой. Однако отдельные атомы обладают энергией значительно большей средней энергии и перемешаются из одного места в другое. Наиболее легко перемешаются атомы поверхностного слоя. Место, где находился такой атом, называется вакансией. На это место через некоторое время перемешается один из атомов соседнего слоя и т. д. Таким образом вакансия перемешается в глубь кристалла. К точечным дефектам (рис. 2.3.) относят атом, внедренный в междоузлие кристаллической решетки, и замешенный атом, когда место атома одного металла замешается в кристаллической решетке другим. Точечные дефекты вызывают местное искажение кристаллической решетки.

|
| Рис. 2.3. Схемы точечных дефектов: а – вакансия; б – атом внедрения; в – примесный атом внедрения |
Линейные дефекты (рис. 2.4.) возникают, когда в результате сдвига на одно межатомное расстояние одной части решетки относительно другой, число рядов атомов в верхней части решетки на один больше, чем в нижней, то есть, появляется как бы лишняя атомная плоскость (экстраплоскость).
Край экстраплоскости, перпендикулярный направлению сдвига, называется краевой или линейной дислокацией. Длина дислокации может достигать многих тысяч межатомных расстояний. Ширина дислокации мала и составляет несколько атомных расстояний. Линейные дефекты, краевые и винтовые дислокации – сильно искажают кристаллическую решетку, создавая напряжения. Перемещаясь под влиянием внешних сил, дислокации скапливаются, достигая критической плотности (1012 на см2). При этом пластичность становится близкой к нулю, происходит трещинообразование и хрупкое разрушение. Дислокации возникают при кристаллизации и могут размножаться под нагрузкой.

|
| Рис. 2.4. Схемы краевой (а) и винтовой (б) дислокаций: АВ – краевая дислокация; ABCD – плоскость скольжения; ВС – винтовая дислокация |
Поверхностные дефекты (рис. 2.5.) представляют собой границы раздела между отдельными кристаллами. На границе раздела атомы расположены менее правильно, чем в его объеме. Кроме того, по границам раздела скапливаются дислокации и вакансии, а также концентрируются примеси, что еще больше нарушает порядок расположения атомов.

|
| Рис. 2.5. Схема поверхностного дефекта – граница зерен (пунктир): А – атом принадлежит обеим решеткам; В – атом не принадлежит ни одной из них; С – атом принадлежит одной из двух решеток |
Прочность металла может либо увеличиваться вследствие искажений кристаллической решетки вблизи границ, либо уменьшаться из-за наличия примесей и концентрации дефектов. Дефекты в кристаллах существенно влияют на свойства металлов.
Неодинаковость физических свойств среды в разных направлениях называют анизотропией. Анизотропия кристаллов обусловлена различием плотности упаковки атомов в решетке в различных направлениях. Все кристаллы анизотропны.
2.2. Кристаллизация
Переход из жидкого состояния в твердое (кристаллическое) называют кристаллизацией. Процессы кристаллизации зависят от температуры и протекают во времени Кривые охлаждения строятся в координатах температура ‑ время.
Теоретический процесс кристаллизации металла без переохлаждения протекает при температуре TS (рис. 2.6.). При достижении идеальной температуры затвердевания TS падение температуры прекращается. Это объясняется тем, что перегруппировка атомов при формировании кристаллической решетки идет с выделением тепла (выделяется скрытая теплота кристаллизации).

|
| Рис. 2.6. Расположение кривых охлаждения в зависимости от скорости охлаждения V < V1 < V2 |
Каждый чистый металл (не сплав) кристаллизуется при строго индивидуальной постоянной температуре. По окончании затвердевания металла температура его снова понижается. Практически кристаллизация протекает при более низкой температуре, т.е. при переохлаждении металла до температур ТП, ТП1, ТП2, (например, кривые 1, 2).
Степень переохлаждения ΔT = TS – ТП зависит от природы и чистоты металла и скорости охлаждения. Чем чище жидкий металл, тем он более склонен к переохлаждению. При увеличении скорости охлаждения степень переохлаждения возрастает, а зерна металла становятся мельче, что улучшает его качество. Для большинства металлов степень переохлаждения при кристаллизации в производственных условиях составляет от 10 до 30 °С. При больших скоростях охлаждения она может достигать сотен градусов.
Процесс кристаллизации состоит из двух стадий: зарождения кристаллов (зародышей или центров кристаллизации) и роста кристаллов из этих центров. При переохлаждении сплава ниже ТП на многих участках жидкого металла образуются способные к росту кристаллические зародыши.

Сначала образовавшиеся кристаллы растут свободно и имеют более или менее правильную геометрическую форму.


Затем при соприкосновении растущих кристаллов их правильная форма нарушается, так как в этих участках рост граней прекращается.
Рост кристалла продолжается только в тех направлениях, где есть свободный доступ жидкого металла. В результате кристаллы, имевшие сначала геометрически правильную форму, после затвердевания получают неправильную форму, их называют кристаллитами или зернами.
Величина зерен зависит от числа центров кристаллизации и скорости роста кристаллов. Чем больше центров кристаллизации, тем мельче зерно металла. На образование центров кристаллизации влияет и скорость охлаждения. Чем выше скорость охлаждения, тем больше возникает центров кристаллизации и, следовательно, мельче зерно металла.
Чтобы получить мелкое зерно, создают искусственные центры кристаллизации. Для этого в расплавленный металл (расплав) вводят специальные вещества, называемые модификаторами.
2.3. Строение металлического слитка
Форма растущих кристаллов определяется не только условиями их касания друг с другом, но и составом сплава, наличием примесей и режимом охлаждения. Обычно механизм образования кристаллов носит дендритный (древовидный) характер, когда рост зародышей происходит с неравномерной скоростью (рис. 2.7.).

| |
| Рис. 2.7. Направления осей роста кристалла | |
После образования зародышей их развитие идет в тех плоскостях и направлениях решетки, которые имеют наибольшую плотность упаковки атомов и минимальное расстояние между ними. В этих направлениях образуются длинные ветви будущего кристалла ‑ так называемые оси (1) первого порядка. В дальнейшем от осей первого порядка начинают расти новые оси (2) - оси второго порядка, от осей второго порядка - оси (3) - третьего порядка и т. д.
Например, стальные слитки получают охлаждением в металлических формах (изложницах) или на установках непрерывной разливки. В изложнице сталь не может затвердеть одновременно во всем объеме из-за невозможности создания равномерной скорости отвода тепла. Поэтому процесс кристаллизации стали начинается у холодных стенок и дна изложницы, а затем распространяется внутрь жидкого металла (рис. 2.8.).

|
| Рис. 2.8. Схема строения стального слитка: а) расположение дендритов в наружных частях слитка; б) строение слитка 1 – стенки изложницы; 2 – мелкие равноосные кристаллы; 3 – древовидные кристаллы; 4 – равноосные неориентированные кристаллы больших размеров; 5 – усадочная рыхлость; 6 – усадочная раковина |
В верхней части слитка, которая затвердевает в последнюю очередь, образуется усадочная раковина 6 вследствие уменьшения объема металла при охлаждении. Под усадочной раковиной металл в зоне 5 получается рыхлым из-за большого количества усадочных пор. Для получения изделий используют только часть слитка, удаляя усадочную раковину и рыхлый металл слитка для последующего переплава.
2.4. Аллотропия металлов
Аллотропией, или полиморфизмом, называют способность металла в твердом состоянии иметь различные кристаллические формы. Процесс перехода из одной кристаллической формы в другую называют аллотропическим превращением. При нагреве чистого металла такое превращение сопровождается поглощением тепла и происходит при постоянной температуре, что связано с необходимостью затраты определенной энергии на перестройку кристаллической решетки.
Например, железо в интервале температур 911 – 1392 °С имеет гранецентрированную кубическую решетку (ГКЦ) γ-Fe. В интервалах до 911 ºС и от 1392 до 1539°С железо имеет объемно-центрированную кубическую решетку (ОЦК) ‑ α-Fe.
2.5. Металлические сплавы
Металлические сплавы— макроскопически однородные системы, состоящие из двух или более сортов атомов металлов (или неметаллов), в которых доминирующими являются атомы металла и которые обладают металлическими свойствами. Свойства металлических сплавов могут быть изменены легированием, механической, термической, термомеханической, радиационной и другими видами обработки.
Легирование— введение в состав металлических сплавов так называемых легирующих элементов (например, в сталь — Cr, Ni, Mo, W, V и др.) для придания сплавам определенных физических, химических или механических свойств.
Классификация сплавов
· по химическому составу
· по числу компонентов
· по числу фаз
· по способу получения
Для изучения процессов, происходящих в сплавах при их превращениях, а также для описания строения сплавов в металловедении используют понятия: компонент, фаза, система.
Компонентами называют вещества, образующие систему. Чистый металл представляет собой однокомпонентную систему, сплав двух металлов - двухкомпонентную систему и т.д. Компонентами могут быть металлы и неметаллы, а также устойчивые, т.е. не диссоциирующие на составные части в рассматриваемых интервалах температур вещества – химические соединения.
Фазой называют однородную часть системы, имеющую одинаковый состав, одно и то же агрегатное состояние и отделенную от остальных частей системы поверхностью раздела, при переходе через которую химический состав или структура вещества изменяются скачкообразно.
Совокупность фаз, находящихся в равновесии при определенных внешних условиях (давлении, температуре), называют системой. Сплав называют однородным (гомогенным), если его структура однофазна, и разнородным (гетерогенным), если его структура состоит из нескольких фаз. Под структурой сплав понимают видимое в микроскоп взаимное расположение фаз, их форму и размеры. Компоненты, входящие в состав сплава, могут образовывать следующие фазы:
· жидкие растворы;
· твердые растворы;
· химические соединения
· механические смеси.
Металлические жидкие растворы (расплавы)представляют собой жидкое негомогенное состояние металлов и их сплавов, которое по большинству характеристик (например, по электропроводности и теплопроводности) ближе к твердому состоянию.
Однородные жидкие растворы характерны почти для всех металлов, растворяющихся друг в друге в жидком состоянии в любых соотношениях.
В однородном жидком растворе атомы растворимого металла (компонента) равномерно распределены среди атомов металла–растворителя.
Лишь немногие металлы растворяются в жидком состоянии ограниченно. И только очень немногие металлы из-за большой разницы в размерах своих атомов не растворяются друг в друге в жидком состоянии. В процессе кристаллизации и затвердевания сплавов взаимодействие компонентов может быть различным. Твердые растворы образуются в результате перехода в твердое состояние однородных жидких растворов.
В твердом растворе одно из веществ, входящих в состав сплава, сохраняет присущую ему кристаллическую решетку, а другое в виде отдельных атомов распределяется в кристаллической решетке первого вещества.
Металлические твердые растворы образуются в результате проникновения в кристаллическую решетку основного металла атомов другого металла или неметалла. Различают твердые растворы замещения (а)и твердые растворы внедрения (б) (рис. 2.9).

|
| Рис. 2.9. Схемы строения решеток твердых растворов замещения (а) и внедрения (б) |
Так как электронное строение и размеры атомов основного металла (растворителя) и растворенного компонента различны, то при образовании металлического твердого раствора кристаллическая решетка всегда искажается, и периоды ее изменяются. При образовании раствора внедрения период решетки растворителя всегда возрастает, а при образовании твердого раствора замещения — может увеличиться или уменьшиться в зависимости от соотношения атомных радиусов растворителя и растворенного компонента.
Большинство металлов в той или иной степени взаимно растворяются друг в друге в твердом состоянии. Например, без изменения типа кристаллической решетки в алюминии может растворяться до 5,5 % Сu, а в меди — 39 % Zn.
Если компоненты могут замещать друг друга в любых количественных соотношениях, то они образуют непрерывный ряд твердых растворов, имеющих одну и ту же кристаллическую решетку. Образование твердых растворов всегда сопровождается увеличением электрического сопротивления и уменьшением его температурного коэффициента. Твердые растворы обычно менее пластичны (исключение составляют твердые растворы на основе меди) и всегда более тверды и прочны, чем чистые металлы.
При этом в значительной мере свойства изменяются в твердых растворах внедрения, так как искажения решетки при их образовании больше.
Полностью упорядоченные твердые растворы (сверхструктуры) образуются, когда отношение компонентов в сплаве равно целому числу: 1:1; 1:2; 1:3 и др. (рис. 3.10.). В этом случае сплаву с упорядоченным строением можно приписать формулу химического соединения, например, CuAu или Сu3Аu. Таким образом, упорядоченные твердые растворы можно рассматривать как промежуточные фазы между твердыми растворами и химическими соединениями.

|
| Рис. 2.10. Кристаллические решетки упорядоченных твердых растворов: а) CuZn; б) CuAu; в) Cu3Au |
В металловедении принято обозначать: чистые компоненты большими буквами латинского алфавита — А, В, С и др.; твердые растворы — малыми буквами греческого алфавита — α, β, γ и др., a упорядоченные твердые растворы теми же буквами со штрихом — α’, β’, γ’ и др.
Понятие «химическое соединение» определяет химически индивидуальное вещество, в котором атомы одного (например, N2 и O2 ) или различных (CuZn, Mо2C) элементов соединены между собой тем или иным видом химической связи. Известно свыше 3 млн. химических соединений. В металлических сплавах это понятие охватывает только химические соединения, образованные из различных компонентов сплава.
Химические соединения, образующиеся в металлических сплавах из различных компонентов, отличаются от типичных химических соединений тем, что не подчиняются законам валентности и не имеют постоянного состава, а от упорядоченных твердых растворов — тем, что сохраняют свою кристаллическую решетку до температуры плавления.
Химические соединения по электронному строению и свойствам разделяют на классы: электронные соединения, интерметаллиды, фазы внедренияи др.
Электронные соединения(электронные фазы) чаще всего образуются между одновалентными (Сu, Ag, Li, Na и др.) металлами или переходными металлами (Fe, Mn, Со и др.) и металлами с валентностью от 2 до 5 (Be, Mg, Zn, Al и др .).
Интерметаллиды (интерметаллические соединения) — химические соединения металлов с металлами и неметаллами (нитриды, карбиды, гидриды и др.), обладающие металлической связью. Интерметаллические соединения образуют переходные металлы (Fe, Mn, Cr, Mo и др.) с углеродом, азотом, бором и водородом, то есть с элементами, имеющими малый атомный радиус. Кристаллическое строение фаз внедрения определяется соотношением атомных радиусов неметалла (Rx) и металла (Rm).
Атомы металла расположены по типу одной из простых решеток (кубической или гексагональной), в определенные пустоты (поры) которой внедрены атомы неметалла. Механическая смесь двух компонентов А и В образуется тогда, когда при кристаллизации компоненты сплава не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Механическая смесь может состоять из зерен двух насыщенных твердых растворов или зерен твердого раствора и химического соединения. В этом случае сплав состоит из кристаллов А и В, которые, если они достаточно крупны, отчетливо выявляются на микроструктуре. Рентгенограмма сплава отчетливо показывает наличие двух решеток компонентов А и В.
2.6. Диаграммы состояния сплавов
Сплавы в подавляющем числе случаев находятся в состоянии, когда они обладают ограниченной устойчивостью. Истинное равновесие в практических условиях достигается редко. Состояние сплава зависит от внешних условий (например, температуры, давления) и характеризуется числом и концентрацией образовавшихся фаз. Для описания фазового состава сплавов в условиях, достаточно близких к равновесному состоянию, применяют диаграмму состояния.
Диаграмма состояния (фазового равновесия) сплава— графическое изображение соотношения между параметрами состояния (температурой, давлением, составом) термодинамически равновесной системы, в зависимости от концентрации компонентов (в процентах по массе или, реже, в атомных процентах) и температуры.
Диаграмма состояния показывает строение сплава в зависимости от соотношения компонентов и от температуры. Обычно применяют проекции диаграммы состояния на одну из координатных плоскостей при постоянном значении остальных параметров, например, на плоскость температур
|
|
|


