 |
Задания для самостоятельной работы.
|
|
|
|
РЕШАЕМ ЗАДАЧИ
ПО ОрганическОЙ химиИ
(часть 1)
Учебное пособие
Новосибирск 2010
УДК 547
ББК …
Колчина Е.Ф., Бредихин Р.А.
Решаем задачи по органической химии / Учеб. пособие. СУНЦ НГУ, Новосибирск, 2010. 59 стр.
В первую часть пособия входят разделы: «метод сожжения» и «углеводороды», который включает в себя подразделы «алканы», «алкены», «алкины» и «арены». В каждой части приведены примеры решения наиболее типичных задач теоретического и синтетического плана, а также расчетных задач. Для самостоятельного решения предлагаются не только задания такого типа, но и в виде тестов (для подготовки к ЕГЭ). И, наконец, приведены варианты потоковой контрольной работы по теме «углеводороды» за 2008 год, которая включает в себя все эти разделы.
В первую часть пособия вошли разделы, посвящённые химии углеводородов. Первый раздел – метод сожжения - представляет собой вводную тему, с которой начинается изучение органической химии в СУНЦ НГУ. Отличительной особенностью этого раздела является большое количество расчётных задач, которое позволяет научиться их решать с самого начала обучения и не испытывать трудностей в дальнейшем.
Главное внимание пособия уделено теме «Углеводороды». Последняя включает в себя главы, традиционно посвящённые различным классам углеводородов: алканам, алкенам, алкинам, алкадиенам и аренам. В каждой главе приведены примеры решения наиболее типичных задач теоретического и синтетического плана, а также расчетных задач. Для самостоятельного решения предлагаются не только задания такого типа, но и в виде тестов (для подготовки к ЕГЭ). И, наконец, приведены варианты потоковой контрольной работы по теме «углеводороды» за 2008 год, которая включает в себя все эти разделы.
|
|
|
Авторы выражают признательность и благодарность всем сотрудникам кафедры химии СУНЦ НГУ за ежедневную помощь в работе и тёплую атмосферу дружбы и сотрудничества.
Рецензент
к.х.н., доцент С.Г. Барам
© СУНЦ НГУ, 2010
© Колчина Е.Ф. Бредихин Р.А., 2010
От авторов
Органическая химия, по определению изучает соединения углерода, их строение и их превращения. Современные теоретические представления прочно внедрились в этот курс и даже несколько потеснили классическую описательную и синтетическую органическую химию. Курс органической химии в СУНЦ НГУ также уделяет повышенное внимание к теоретическим аспектам этой науки. Но порою складывается такая ситуация, что учащиеся, хорошо разбирающиеся в сложных теоретических вопросах, не могут решить простую расчетную задачу или затрудняются при разработке стратегии даже несложного органического синтеза.
Так возникла идея написания этого учебного пособия, в котором мы постарались показать, как применять те или иные теоретические знания для решения конкретных расчетных и синтетических задач.
С уважением,
Е.Ф.
С чего начать? Наверное, с отношения. Друзья, Вы начинаете изучение курса органической химии, и, пожалуй, основная проблема при его освоении состоит в недостаточно добросовестном отношении к этому предмету. Согласен, он кажется трудным, непонятным, оттого – сложным. На самом деле, ничего сложного в органической химии нет. Случалось ли Вам в детстве (давно это было!) собирать конструктор? Не сомневаюсь, приходилось, а у многих из Вас эта игрушка по праву была одной из любимых.
Так вот, органическая химия – точно такой же конструктор, только «для взрослых». В роли «кубиков» выступают атомы химических элементов, «соединения» кубиков – ковалентные связи, а наш курс органической химии – это лишь набор правил, согласно которым можно собирать конструктор. Так, «кубик» атома углерода может быть совмещен не более, чем с четырьмя другими «кубиками» и ровно с четырьмя «кубиками» водорода или, например, хлора. Изучая органическую химию, Вы, на самом деле, должны лишь усвоить и уметь применять основные правила сборки этого конструктора – и всё! Таким образом, Ваша борьба с этим предметом может стать поистине интересной и захватывающей. Скажу только, что в этой борьбе учителя находятся «в резерве» на Вашей (!) стороне, к ним Вы всегда можете обратиться за разъяснениями и помощью.
|
|
|
Самые задиристые из Вас, безусловно, заметят (и вполне резонно!), что для игры в детский конструктор никакие преподаватели им не требовались. Ну что же, Вы совершенно правы: гораздо увлекательнее и полезнее самому постигать правила игры! А если возникнут трудности – обратиться, наконец, к инструкции – учебнику или конспекту.
И, наконец, обращу Ваше внимание вот на что: «взрослый» конструктор химии значительно богаче «детского», ведь собирая новую правильную комбинацию, Вы, на самом деле, получаете некоторое соединение – вещество, обладающее какими-то новыми свойствами, которых не было у Ваших «кубиков». Запах «дюшес» этилацетата, кислый вкус уксуса, синий цвет красителя «индиго» – всё в Ваших руках! Желаю успеха!
Искренне Ваш,
BR
ВВЕДЕНИЕ В ОРГАНИЧЕСКУЮ ХИМИЮ
Возможные вопросы, которые совершенно случайно J могут быть Вам предложены преподавателем на первом занятии
1. Какая связь называется ковалентной?
2. Какие типы ковалентной связи Вам известны?
3. Какие Вы знаете свойства ковалентной связи?
4. По каким механизмам может быть образована ковалентная связь?
5. Опишите различные механизмы разрыва ковалентной связи. Как они называются?
6. Какие частицы возникают при гомолитическом разрыве ковалентной связи? Приведите пример.
7. Какие частицы возникают при гетеролитическом разрыве ковалентной связи? Приведите пример.
8. Какое явление получило название гибридизация?
|
|
|
9. Какие типы гибридизации атома углерода Вам известны? Приведите примеры.
10. Что такое брутто-формула?
11. Какая формула называется структурной?
12. Какие вещества называются изомерами?
13. Что такое гомологический ряд?
1. МЕТОД СОЖЖЕНИЯ
Ежедневно синтезируются сотни (если не тысячи) новых органических соединений. И состав, и строение каждого нового вещества должно быть доказано. Для этого существует целый комплекс аналитических и физико-химических методов, одним из которых является метод определения состава органического вещества по результатам его сожжения. Под понятием «состав» подразумевается его молекулярная или брутто- формула, которая показывает, из какого числа каких атомов состоит молекула органического соединения.
Если вещество состоит только из углерода и водорода (углеводороды), или является кислородсодержащим органическим соединением, то при сожжении в кислороде получаются только вода и диоксид углерода (углекислый газ), т.е. углерод из состава органической молекулы переходит в углекислый газ, водород – в воду, Такой процесс можно выразить уравнением:
| CXHYOZ + (x + y/4 – z/2) O2 ® x CO2 + y/2 H2O |
Если в состав органического соединения входит азот, то, как правило, он выделяется в виде молекулярного азота, и уравнение сгорания будет выглядеть так:
| 2CXHYNZ + (2x + y/2) O2 ® zN2 + 2x CO2 + y H2O |
Если в состав органического вещества входит сера, в продуктах реакции образуется диоксид серы, а фосфор из состава органического вещества сгорает до оксида фосфора, который реагирует с водой из состава продуктов реакции и превращается в ортофосфорную кислоту.
Анализируя количественный состав продуктов реакции, можно определить соотношение атомов в молекуле исходного органического соединения, т.е. узнать его эмпирическую формулу. Используя дополнительные данные о молярной массе вещества определяем его молекулярную формулу. Рассмотрим решение на конкретных примерах. Итак, решаем задачи.
Пример 1.
Определите эмпирическую, молекулярную и одну из возможных структурных формулы органического вещества, если известно, что при сожжении его образца массой 30 г получены углекислый газ объемом 47 л (н.у.) и вода массой 43,2 г. Плотность паров этого вещества по кислороду равна 3,125.
|
|
|
Решение.
Анализ продуктов сгорания свидетельствует, что в состав неизвестного органического вещества должны входить следующие элементы: углерод, водород. Вопрос о присутствии кислорода в составе органического вещества требует расчёта.
Уравнение реакции:
CxHyOz + aO2 = xCO2 + y/2H2O, где a=(2x+y/2-z)/2
Рассчитаем массы углерода и водорода, входящих в состав органического соединения и сравним с массой навески. Если сумма масс элементов окажется меньше, чем масса навески, значит, в состав соединения кроме углерода и водорода входит кислород. Объём углекислого газа 47л при н.у., что составляет 47/22.4=2.10 моль. mC=25.2г. mH2O=43.2г Количество вещества H2O=2.4 моль. mH=2.4×2=4.8г. mC+mH=25.2+4.8=30.0г. Кислорода в органическом соединении нет, вещество является углеводородом CxHy. Соотношение углерода и водорода 4.8:2.1=2.29, что даёт наименьшую пару целых чисел x и y x=7, y=16 – эмпирическую формулу (CH2.29)n. Молярная масса соединения равна M=32×3.125=100 г/моль, что соответствует молекулярной формуле C7H16. Одна из возможных структурных формул – н -гептан CH3-(CH2)5-CH3.
Пример 2
Органическое вещество имеет процентный состав: углерод – 32,43%; водород – 3,60 %; хлор – 63,96 %. Определите его эмпирическую, молекулярную и две структурные формулы, если плотность по воздуху паров этого вещества составляет 3,79.
Решение.
Необходимо от масс. % перейти к количественным. Для этого масс. % делим на атомную массу элемента и берём отношение. 0.3243/12:0.036/1:0.6396/35.5=0.027:0.036:0.018=3:4:2. Таким образом, формула соединения (C3H4Cl2)n – эмпирическая формула. Из значения плотности паров по воздуху находим молярную массу M=D×Mвоздуха = 3.79×29≈110г/моль. Молекулярная формула совпадает с эмпирической при n=1. Структурные формулы: Cl2C=CH-CH3, H2C=CH-CHCl2.
Задания для самостоятельной работы.
1.1 Определите эмпирическую, молекулярную и одну из возможных структурных формулы органического вещества, если известно, что при сожжении его образца массой 34,8г получены углекислый газ массой 79,2г и вода массой 32,4г. Плотность паров этого вещества по воздуху равна 2.
1.2 Определите эмпирическую, молекулярную и одну из возможных структурных формулы органического вещества, если известно, что при сожжении его образца массой 35,2г получены углекислый газ объемом 36л и вода массой 28,8г. Плотность паров этого вещества по воздуху равна 1,52.
1.3 Определите эмпирическую, молекулярную и одну из возможных структурных формулы органического вещества, если известно, что при сожжении его образца массой 17,2г получены углекислый газ массой 52,8г и вода массой 25,2 г. Плотность паров этого вещества по воздуху равна 2,97.
|
|
|
1.4 Определите эмпирическую, молекулярную и одну из возможных структурных формулы органического вещества, если известно, что при сожжении его образца массой 17,5г получены углекислый газ объемом 28л и вода массой 22,5г. Плотность паров этого вещества по кислороду равна 2,19.
1.5 Определите эмпирическую, молекулярную и одну из возможных структурных формулы органического вещества, если известно, что при сожжении его образца массой 9,2г получены углекислый газ массой 17,6г и вода массой 10,8г. Плотность паров этого вещества по воздуху равна 1,59.
1.6 Определите эмпирическую, молекулярную и одну из возможных структурных формулы органического вещества, если известно, что при сожжении его образца массой 8,6 г получены углекислый газ объемом 13,44 л и вода массой 12,6 г. Плотность паров этого вещества по кислороду равна 2,625.
1.7 Определите эмпирическую, молекулярную и одну из возможных структурных формулы органического вещества, если известно, что при сожжении его образца массой 27,6 г получены углекислый газ объемом 27 л и вода массой 32,4 г. Плотность паров этого вещества по кислороду равна 1,44.
1.8 Определите эмпирическую, молекулярную и одну из возможных структурных формулы органического вещества, если известно, что при сожжении его образца массой 7г получены углекислый газ массой 22г и вода массой 9г. Плотность паров этого вещества по воздуху равна 2,41.
1.9 Органическое вещество имеет процентный состав: углерод – 38,4%; водород – 4,8%; хлор – 56,8%. Определите его эмпирическую, молекулярную и две структурные формулы, если плотность паров этого вещества составляет 5,58 г/л.
1.10 Органическое вещество имеет процентный состав: углерод – 37,79%; водород – 6,30%; хлор – 55,91%. Определите его эмпирическую, молекулярную и две структурные формулы, если плотность паров этого вещества составляет 5,67 г/л.
1.11 Органическое вещество имеет процентный состав: углерод – 31,86%; водород – 5,31%; хлор – 62,83%. Определите его эмпирическую, молекулярную и две структурные формулы, если плотность паров этого вещества составляет 5,04 г/л.
1.12 Органическое вещество имеет процентный состав: углерод – 32,43%; водород – 3,60 %; хлор – 63,96 %. Определите его эмпирическую, молекулярную и две структурные формулы, если плотность паров этого вещества составляет 4,96 г/л.
1.13 */ При сжигании 5,65 г хлорпроизводного X предельного углеводорода образовалась газовая смесь, которую последовательно пропустили через трубку с карбонатом кальция и далее через трубку с оксидом фосфора (V). Определите молекулярную формулу хлорпроизводного X, изобразите его изомеры, запишите уравнения всех реакций. Известно, что масса трубки с карбонатом кальция увеличилась на 0,55г, а масса трубки с оксидом фосфора – на 2,7г, а объём газовой смеси на выходе составил 4,48л (н.у).
1.14 */ При сжигании 9,9г некоторого азотсодержащего органического вещества образовалась газовая смесь с плотностью по кислороду 0,8594. После охлаждения масса газовой смеси уменьшилась на 13,86г, а её плотность по кислороду возросла до 1,275. Определите эмпирическую формулу анализируемого соединения.
1.15 */ В замкнутом реакторе проводят реакцию некоторого предельного углеводорода с кислородом. Реакция протекает в газовой фазе в изотермическом режиме, реагенты взяты в необходимых стехиометрических соотношениях, начальное давление равно P. Определите брутто-формулу анализируемого образца, изобразите структуры всех его изомеров, если конечное давление после окончания реакции равно 1,2 P.
УГЛЕВОДОРОДЫ
ПРЕДЕЛЬНЫЕ
2. АЛКАНЫ
Изомерия и номенклатура
Первостепенную роль в любой области знания и техники играет номенклатура – набор названий, терминов и определений. Фактически это тот самый язык, с помощью которого мы передаем информацию. Очевидно, что тот, кто владеет этим искусством, не испытывает затруднений в общении с коллегами, чтении специальной литературы, передаче знаний. Однако, тот, кто не знает этого языка, многого не в состоянии понять. Для такого человека разговор «посвященных» - сплошная тарабарщина. Так давайте разговаривать на языке, понятном всем химикам в мире.
Правила построения названий органических соединений в разных номенклатурах изложены в любом учебнике по органической химии[*],[†],[‡],[§]. Для того, чтобы с успехом их применять, необходимо знать наизусть названия первых десяти алканов нормального строения, а также названия всех радикалов с числом атомов углерода от 1 до 4. Это обязательно!
По теме «номенклатура» имеется несколько типов задач, среди них такие:
1) назвать изображенные структурные формулы по определенной номенклатуре;
2) по названию органического соединения построить его структурную формулу;
3) определить, правильно ли названо органическое вещество.
Пример 1.
Изобразить структурную формулу 2,2,5,7-тетраметил-3-этил-4,6-диизопропил-4-третбутилоктана.
Решение.
| Название приведено по номенклатуре IUPAC: за основу выбрана самая длинная углеродная цепочка, название которой составляет корень слова. «Октан» - это цепочка, содержащая из 8 атомов углерода, поэтому изображаем главную цепь и нумеруем атомы углерода: | С1- С2- С3- С4-С5- С6- С7- С8 |
| Теперь обращаемся к началу названия. «Метил» - это группа -СН3, т.е. радикал, полученный из метана. Слово «тетра» означает, что к основной цепочке присоединено 4 таких группы. Цифры в начале указывают номера тех атомов углерода, к которым присоединены эти радикалы: | 
|
| «Этил» – группу -СН2СН3 (радикал, полученный из этана), располагаем у атома углерода под номером 3 (рис. 2). «Изопропил» – радикал разветвленного строения, полученный из пропана: CH3CHCH3. Две изопропильные группы размещаем в положениях 4 и 6 главной углеродной цепи: | 
|
| Наконец, к 4 атому углерода необходимо приписать третбутильную группу: | 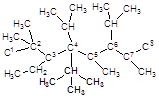
|
| Поскольку каждый атом углерода четырехвалентен, все свободные валентности заполняем атомами водорода. Итак, структурная формула построена. | 
|
Пример 2.
Каково строение углеводорода С7Н16 , если известно, что число первичных, вторичных и третичных атомов водорода относятся как 9:6:1, причём все атомы каждого типа эквивалентны? Назовите его по номенклатуре IUPAC.
Решение.
Прежде всего, вспомним, какие атомы водорода называются «первичными», «вторичными» и «третичными». Атом углерода, связанный с одним другим атомом углерода, называется первичным, с двумя другими атомами углерода – вторичным, с тремя другими атомами углерода – третичным. Атом водорода, связанный с первичным атомом углерода, называется первичным, с вторичным – вторичным и с третичным – третичным атомом водорода.
Сумма (9 + 6 + 1) = 16 соответствует количеству атомов водорода в молекуле исходного алкана. 9 первичных атомов Н – это три метильные группы –СН3, 6 вторичных – три метиленовые группы –СН2- и один третичный – это группа –СН-. Учитывая условие об эквивалентности (т.е. одинаковости) каждого типа атомов водорода, можно предложить только одну структурную формулу: (СН3-СН2-)3СН – 3-этилпентан.

Химические свойства и способы получения.
Пример 3.
Определите строение углеводорода С6Н14 , если известно, чтопо методу Вюрца он может быть получен без побочных продуктов, а при бромировании образует третичный бромалкан С6Н13 Br. Назовите его по номенклатуре IUPAC.
Решение.
Условие задачи о том, что по реакции Вюрца алкан получен без побочных продуктов, указывает на симметричность молекулы. Для углеводорода С6Н14 существует две симметричные структуры:

Однако, третичный атом водорода (который может замещаться на атом брома) имеется только во втором изомере. Итак, всем условиям задачи удовлетворяет молекула: 2,3-диметилбутан.
Пример 4.
Какой алкан получится при декарбоксилировании натриевой соли карбоновой кислоты, электролиз водного раствора которой приводит к образованию 2,3-диметилбутана?
Решение.
Электролиз водных растворов калиевых и натриевых солей карбоновых кислот приводит к получению алканов по уравнению:

Поскольку по условию задачи образовался 2,3-диметилбутан:

Декарбоксилирование осуществляется при нагревании солей карбоновых кислот с гидроксидом натрия в присутствии оксида кальция по уравнению:

Образуется алкан – пропан.
Пример 5.
Предложите схемы получения из метилпропана: а) 2,5-диметилгексана; б) 2,2,3,3-тетраметилбутана.
Решение.
Прежде всего изобразим структурные формулы исходного вещества и тех соединений, которые нам надо синтезировать. При их визуальном сравнении можно видеть, что углеродный скелет каждой из получаемых молекул представляет собой «удвоенный» углеродный скелет исходного вещества.

Только в случае а) эти скелеты «сшиваются» через крайние – первичные атомы углерода, а в случае б) – через центральные – третичные. Способом «сшивки» одинаковых углеводородных радикалов является синтез Вюрца – взаимодействие галоидалканов с натрием:
2 R - Hlg + 2 Na ® R - R + 2 NaCl.
Галоидалканы можно получить галогенированием исходного метилпропана при освещении. Использование хлора приводит к образованию в качестве основного продукта – 2-метил-1-хлорпропана. Бромирование в этих условиях является процессом «селективным», т.е. замещение атома водорода на атом брома происходит преимущественно у третичного атома углерода, и приводит к получению 2-бром-2-метилпропана.
С учетом всего сказанного можно предложить следующие схемы получения:
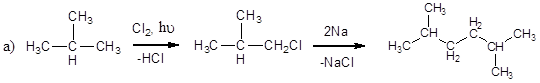

|
|
|


