 |
Что может являться промежуточным продуктом X в схеме превращений?
|
|
|
|

1) 2-метилбутандиол-2,3 3) 2-метил-2,3-дибромбутан
2) 3-метилбутанол-2 4) 2-метилбутанол-2
10. В реакции моноацетиленида натрия и н-бутилиодида были получены следующие органические продукты:
1) гексин-1 3) н -бутилнатрий и йодацетилен
2) бутен-1 и ацетилен 4) бутин-1 и бутен-1
5. СОПРЯЖЁННЫЕ АЛКАДИЕНЫ
Номенклатура и изомерия
Само название алкадиены указывает на то, что в структуре молекул углеводородов этого класса присутствуют две двойные связи. Номенклатура диенов подчиняется общим правилам, сформулированным для построения названия алкенов: главная цепь должна содержать обе двойные связи и при этом иметь максимальную длину. При этом в названии соответствующего алкана суффикс -ан заменяют на суффикс -диен и указывают номера атомов углерода при двойных связях. При этом номера должны быть наименьшими из возможных.
Пример

| 
| 
| 
|
| Пентадиен-1,4 | Бутадиен-1,3 | Пропадиен-1,2 | Циклопентадиен[††] |
Все алкадиены можно разделить на три группы. В первую из них отнесём те молекулы, двойные связи в которых расположены очень далеко друг от друга (разделены хотя бы одним sp3 -гибридным атомом углерода). Их называют изолированными (пентадиен-1,4). Такое название хорошо подчёркивает, что каждая из двойных связей в химических реакциях будет вести себя независимо, «изолированно». В таком случае можно заключить, что химические свойства изолированных диенов в точности совпадают с химическими свойствами хорошо Вам известных алкенов. Поэтому в школьном курсе химии (да и в университетском J) эти углеводороды практически не рассматриваются.
|
|
|
В составе молекул другой группы диенов присутствует атом углерода, принимающий участие в образовании сразу двух двойных связей. Такие диены называются кумулированными (пропадиен). Увы, эти замечательные молекулы также не входят в курс школьной химии.
Наконец, самая важная группа диенов – те, в молекулах которых две двойные связи разделены простой s-связью. Эти диены получили название сопряжённые (бутадиен-1,3). Именно на них следует сосредоточить своё внимание.
Для диенов характерна изомерия углеродного скелета, положения кратной связи (изолированные, кумулированные, сопряжённые), межклассовая (с алкинами, циклоалкенами, бициклоалканами), может быть пространственная изомерия (цис- / транс- конфигурация каждой из двойных связей).
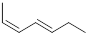
В научных публикациях обычно указывают, какой пространственный изомер был выбран для работы. Для этого указывают конфигурацию заместителей при каждой двойной связи. Вы знаете о цис- / транс- изомерах. А что делать, если заместители все разные? В этом случае на помощь приходит понятие E- и Z- изомеры. У каждого атома углерода при двойной связи есть пара заместителей. Из них выбирают самый «тяжёлый»[‡‡] и смотрят, как выбранные заместители расположены друг относительно друга. Если по одну сторону от двойной связи, то Z- изомер, если по разные – E- изомер.
Пример

| 
| 
| 
|
| (2 Z, 4 Z)-гептадиен-2,4 | (2 E, 4 Z)-гептадиен-2,4 | (2 Z, 4 E)-гептадиен-2,4 | (2 E, 4 E)-гептадиен-2,4 |
Строение сопряжённых диенов
Особенность строения сопряжённых диенов легко проиллюстрировать на примере бутадиена-1,3. Изобразим p-связи.

Нетрудно заметить, что если все четыре p -орбитали sp2 -гибридных атомов углерода расположены в одной плоскости, то p -орбитали атомов углерода C2 и C3 также образуют между собой подобие p-связи (два p -облака перекрываются по p-типу).
К чему это приводит? Ясно, что раз есть дополнительное перекрывание атомных орбиталей, значит, связь C2–C3 более прочная, чем простая s-связь. Как Вы знаете, это проявляется в уменьшении длины связи и увеличении её энергии. Напротив, двойные связи вынуждены «поделиться» своей электронной плотностью, следовательно, их длина оказывается несколько больше, чем длина двойной углерод-углеродной связи алкенов, а энергия – несколько меньше[§§]. Вместе с тем, образуется единая p-система из четырёх атомов углерода. Значит, эти атомы в химических превращениях будут вести себя как единое целое. Подобный эффект выравнивания электронной плотности в результате перекрывания орбиталей разных двойных связей, получил название сопряжение. В рассматриваемом нами случае в сопряжение вступают две p-связи, поэтому мы имеем дело с p-p-сопряжением.
|
|
|
Способы получения диенов
В основном, способы получения диенов в точности соответствуют тем методам создания двойных связей, которые Вам уже известны: дегидрирование, дегидрогалогенирование, дегалогенирование, дегидратация. Положение двойных связей (региоселективность) достигается расположением функциональных групп в молекуле субстрата.
Пример 1
Предложите схему получения 4-метилпентадиена-1,3 из изобутана и неорганических реагентов.
Решение
Задачу будем решать в обратном порядке. Первый взгляд показывает, что синтез Вюрца нас в корне не устраивает – структура несимметрична. В задании дана подсказка, что следует использовать изобутан. Поэтому наша молекула разбивается на два кусочка, изобутан и этан, которые нужно «связать» в ходе синтеза.
Какая стадия будет последней? По‑видимому, создание сопряжённых двойных связей, так как «пришивать» к диену углеродные фрагменты мы не умеем. В качестве «заготовки» для получения 1,3-диена обычно используют алкен. Присоединение к нему молекулы галогена с последующим дегидрогалогенированием приводит к получению диена (1). Теперь целевым соединением является 4-метилпентен-2, который мы получим из 4-метилпентена-1 присоединением по правилу Марковникова с последующим элиминированием по правилу Зайцева (2). 4-Метилпентен-1 может быть получен из 4‑метилпентина-1 гидрированием на отравленном катализаторе (3). В качестве ключевой стадии синтеза будем использовать реакцию ацетиленида натрия с доступным изобутилхлоридом (4).
|
|
|
 Разбиение на фрагменты
Разбиение на фрагменты
| Аналитическая схема («ретросинтетическая»)

|
Для того, чтобы лучше разобраться с решением этой задачи, ответьте на следующие вопросы: (1). Подумайте, какие побочные продукты дегидрогалогенирования могут образоваться на последнем шаге? Напишите уравнения реакций, приводящих к их образованию. (2). Сформулируйте правило Марковникова и правило Зайцева. Приведите по одному примеру применения этих правил. (3). Что такое отравленный катализатор? Что произойдёт, если мы выберем «обычный» катализатор гидрирования – никель или платину? Напишите уравнение реакции. (4). Какой побочный процесс будет происходить в данном случае (несмотря на то, что изобутилхлорид – первичный алкилгалогенид, наличие двух метильных групп по соседству с хлором придаёт ему сходство с вторичными и третичными алкилгалогенидами). Напишите уравнение реакции.
А теперь – создаём по аналитической схеме схему синтеза.




Химические свойства диенов
Особенность сопряжённых диенов наиболее ярко проявляется в их химических свойствах. Так, при взаимодействии бутадиена-1,3 с эквимолярным (таким же) количеством бромоводорода наблюдается образование двух продуктов: ожидаемого 3-бромбутена-1 и «неожиданного» 1-бромбутена-2.

Термины 1,2- и 1,4-присоединение показывают, к каким атомам сопряжённой p-системы происходит присоединение. Образование первого продукта легко объяснить присоединением брома по одной из двойных связей, в то время как образование второго продукта вызывает вопросы. Как Вы понимаете, ответ лежит в механизме процесса.
Основные стадии механизма электрофильного присоединения к диенам соответствуют таковым для электрофильного присоединения к двойной связи алкенов.
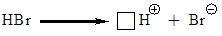 (образование активной частицы)
(образование активной частицы)

В этом случае Вам нетрудно сделать выбор более устойчивого карбокатиона. Раз в катионе Б при атоме углерода с положительным зарядом располагаются два заместителя с положительным индуктивным эффектом (а не один, как в катионе А), то он и устойчивее. Однако не всё так просто. Давайте вернёмся к картинке орбиталей p-системы. Образование s‑комплекса приводит к изменению гибридизации одного из атомов углерода с sp2 до sp3. Разумеется, при этом его p -орбиталь «выбывает» из p-системы.
|
|
|
(А)  (Б)
(Б) 
В то время как в катионе А вакантная p -орбиталь изолирована от p-связи, в катионе Б p ‑орбиталь, напротив, примыкает к двойной связи. Как Вы помните, электроны p-связи гораздо более «подвижны», поэтому под действием положительного заряда происходит поляризация («перетекание» электронной плотности) p-связи. При этом p-связь проявляет положительный мезомерный эффект. Этот эффект гораздо более весом, чем положительный индуктивный эффект алкильной группы и в большинстве случаев оказывает решающее влияние. Таким образом, на данном примере мы познакомились с ещё одним типом сопряжения – взаимодействием p‑ орбитали с электронами p-связи, т.е. p-p-сопряжением.
Резонансные структуры
Смещение электронов p-связи приводит к накоплению отрицательного заряда на атоме углерода C2 и, напротив, к появлению дефицита электронной плотности на атоме углерода C1. Таким образом, под действием положительного заряда происходит поляризация p-связи. В предельном случае электронная плотность сконцентрирована на атоме углерода C2, в то время как атомы углерода C1 и C3 лишены электронной плотности, т.е. несут положительный заряд.
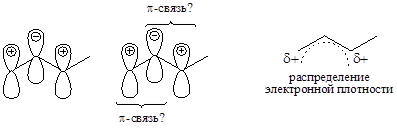
Анализируем полученную картину распределения электронной плотности. Очевидно, атом углерода C2 может образовать p-связь как с атомом углерода C1, так и с атомом углерода С3. Действительная структура карбокатиона представляет собой «компромисс» двух крайних случаев. Эти структуры получили название предельных, иначе резонансных.
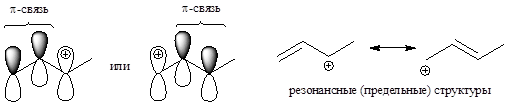
Необходимые замечания:
1. Резонансная структура представляет собой картину распределения электронной плотности в молекуле или частице. Поэтому при изображении различных резонансных структур все атомы и s-связи остаются на месте[***].
2. Необходимо чётко осознать, что резонансных структур в действительности не существует, на самом деле частица ведёт себя, как будто представляет собой «сумму» этих структур. Поэтому отдельная резонансная структура лишена какого бы то ни было смысла, важен набор резонансных структур, т.е. всех возможных картин распределения электронной плотности. При этом между резонансными структурами ставится значок обоюдоострой стрелочки «↔». Это не равновесие, это разные варианты распределения электронной плотности в одной молекуле!
|
|
|
3. Каждая структура характеризуется определённой долей (вкладом) в истинное распределение электронной плотности. Чем больше вклад, тем лучше отражает данная структура реальную картину. На практике этот вклад оценивают лишь качественно (больше/меньше), хотя он может быть рассчитан квантово-химическими методами.
В рассматриваемом нами случае имеет место противоборство двух тенденций. С одной стороны, вторичный карбокатион более устойчив, чем первичный, что способствует структуре с зарядом на атоме углерода C3. С другой стороны (и это оказывается более важным!) чем больше заместителей при двойной связи, тем выше устойчивость алкена. Это способствует структуре с положительным зарядом на атоме углерода С1 и двойной связи между атомами углерода С2-С3.
Суммируя всё вышесказанное, мы приходим к общему однозначному заключению, что карбокатион Б намного устойчивее, чем карбокатион А.

Таким образом, при присоединении 1 моль реагента к сопряжённым алкадиенам всегда получается смесь продуктов 1,2- и 1,4-присоединения.[†††]
Кинетический и термодинамический контроль
Оказалось, что соотношение продуктов 1,2- и 1,4-присоединения изменяется в зависимости от температуры процесса. Так, при низкой температуре (-80°C) в реакционной смеси преимущественно образуется продукт 1,2-присоединения. При увеличении температуры реакции соотношение продуктов 1,2- и 1,4-присоединения постепенно выравнивается и, наконец, при дальнейшем увеличении температуры, основным становится 1,4-изомер.
С чем это связано? Продукт 1,2-присоединения при низкой температуре образуется быстрее (продукт кинетического контроля). При увеличении температуры скорости реакций выравниваются – и преимущественно образуется более устойчивый продукт 1,4-присоединения – продукт термодинамического контроля.
Самое интересное и важное состоит в том, что нагревание при 40°C смеси продуктов, полученных при -80°C, приводит к той же смеси продуктов, которая получилась бы при проведении реакции при 40°C! Подумайте, верно ли обратное? Этот эффект достигается благодаря обратимости реакции присоединения.
Пример 2
Приведите структуры продуктов полученных в результате следующей последовательности реакций:

Решение
Электрофильное присоединение к сопряжённым диенам 1 моль реагента при низкой температуре протекает как 1,2-присоединение. Таким образом, продукт X представляет собой 3,4-дибромбутен-1. Реакция последнего с хлором представляет собой электрофильное присоединение к алкенам, о котором Вам всё известно. Таким образом, продуктом реакции является 1,2-дибром-3,4-дихлорбутан. Структуры продуктов Вы без проблем изобразите сами.
Пример 3
Приведите структуры продуктов полученных в результате следующей последовательности реакций:

Решение
Особенностью предлагаемого задания является специфический реагент – перманганат калия на холоду. Задание-ловушка. Предлагаемая Вам реакция – окисление, поэтому её механизм отличается от рассмотренного выше механизма электрофильного присоединения. Перманганат калия на холоду преимущественно будет реагировать с одной из двойных связей бутадиена-1,3 с образованием двухатомного спирта. При более высокой температуре произойдёт более глубокое окисление, а не 1,4-присоединение. Гидрирование на второй стадии восстанавливает оставшуюся двойную связь.
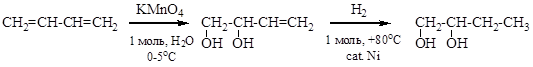
|
|
|


