 |
Задачи для самостоятельного решения
|
|
|
|
5.1 На примере изомеров брутто-формулы С6H10 продемонстрируйте различные типы изомерии. Назовите все соединения по международной номенклатуре. Выберите среди изображённых Вами соединений изолированные, сопряжённые и кумулированные диены. Если таких структур нет, изобразите их и назовите.
5.2 Изобразите возможные резонансные структуры для следующих частиц

5.3 Изобразите возможные резонансные структуры для следующих частиц. Не забудьте, что функциональные группы также могут принимать участие в распределении заряда (резонансные структуры!)

5.4 Приведите структуры соединений, полученных в следующей последовательности превращений, назовите их (кроме D1).

5.5 Напишите уравнения реакций к схеме превращений

5.6 Раскройте механизм реакции гексадиена-2,4 с хлороводородом (1 моль). Какие продукты могут быть получены при а) -90°C? б) +90°C? в) +10°C?
5.7 Раскройте механизм реакции бутадиена-1,3 с эквимольным количеством брома.
5.8 Продукты реакции гексадиена-2,4 с эквимольным количеством брома при 100°C охладили до -80°C. Как изменилось соотношение продуктов? Ответ обосновать.
5.9 Приведите пример синтеза бутадиена-1,3 из неорганических реагентов.
5.10 Напишите схему синтеза пентадиена-1,3 из неорганических реагентов.
5.11 */ Предложите метод получения пентадиена-1,4 из неорганических реагентов.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
6.АРЕНЫ
Арены, или ароматические углеводороды, отвечают общей формуле CnH2n-6. В молекулах аренов присутствует так называемое, ароматическое кольцо, состоящее из цикла, в котором чередуются простые и кратные связи (обычно двойные). В молекуле бензола - простейшего представителя класса аренов – нетрудно рассмотреть фрагменты сопряжённого 1,4-диена (бутадиена-1,3). Как Вы знаете, в сопряжённых диенах, длины двойных углерод-углеродных связей увеличены, а простой углерод-углеродной связи между атомами C2 и C3 – сокращена в результате π-π сопряжения. Этот же эффект наблюдается в молекуле бензола: все углерод-углеродные связи выровнены по длине, которая имеет промежуточное значение между длиной простой и двойной углерод-углеродной связей. Таким образом, за счёт π-π сопряжения корректным изображением распределения электронной плотности должно являться кольцо, означающее, что каждый из 6 атомов углерода предоставляет 1 электрон в общую π-систему. Однако, такой способ изображения малоинформативен для описания механизмов химических реакций, поэтому чаще используют структуры с локализованными двойными связями.
|
|
|
Номенклатура и изомерия.
За основу номенклатуры аренов, как правило, берут ароматическое кольцо («бензол») и указывают, какой радикал или функциональная группа соединены с ним. Как Вы понимаете, в некоторых случаях, напротив, бензольное кольцо выступает как радикал, которые заместил атом водорода. В таком случае радикал C6H5 называют «фенил».
Примеры

| 
| 
| 
|
| Этилбензол | 2-Фенил-3-метилпентан | Аланин (2‑аминопропановая кислота) | Фенилаланин (3‑фенил-2-аминопропановая кислота) |
При наличии в ароматическом кольце нескольких заместителей их нумеруют таким образом, чтобы заместители получили наиболее низкие возможные номера. Наименьшие цифровые индексы придаются положениям, которые следуют в названии первыми.
Как правильно: 4-бромнитробензол или 4-нитробромбензол? Этому вопросу, как правило, не уделяют внимания в школьной программе, и он, оставаясь в тени, так и не получает ответа. По правилам номенклатуры IUPAC при названии соединения заместители располагаются в алфавитном порядке. Таким образом, правильно называть 1-бром-4-нитробензол.
|
|
|
Примеры

| 
| 
| 
|
| 1-Бром-4‑хлорбензол | 1-Метил-4‑нитронафталин | 1-Метил-4‑этилнафталин | 1-бром-4-нитробензол |
Для ряда производных бензола приняты тривиальные названия, которые являются общеупотребительными: анизол (метоксибензол), анилин (аминобензол), бензойная кислота (карбоксибензол), бензолсульфокислота, стирол (винилбензол, 1‑фенилэтилен), толуол (метилбензол), ксилол (диметилбензол), крезол (метилгидроксибензол), фенол (гидроксибензол). Эти названия широкоупотребительны, поэтому их надо помнить.
Примеры

| 
| 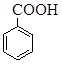
| 
| 
|
| Анизол | Анилин | Бензойная кислота | Бензолсульфокислота | Мезитилен |

| 
| 
| 
| 
|
| Стирол | Толуол | Ксилолы | Крезолы | Фенол |
Ещё одна особенность номенклатуры аренов состоит в названии дизамещённых производных. Так, 2 заместителя могут располагаться при соседних атомах углерода, через один, или же противостоять друг другу. Согласно правилам номенклатуры IUPAC, такие соединения называются 1,2-, 1,3- и 1,4-изомерами, однако вместо них широко распространены приставки орто- (о-), мета- (м-) и пара - (п-). Последние обозначения применяют только в случае дизамещённых аренов.
Примеры

| 1,2-диметилбензол; орто- диметилбензол; орто- ксилол | 
| 1,3-диметилбензол; мета- диметилбензол; мета- ксилол |
|
| 1,4-диметилбензол; пара- диметилбензол; пара- ксилол | ||
Способы получения
Ароматические соединения являются компонентами нефти и каменноугольной смолы, однако потребность в них настолько велика, что разработаны методы их промышленного получения. В первую очередь, следует отметить реакцию тримеризации алкинов, в частности, ацетилена. Следующая группа реакций основана на процессах дегидрирования и ароматизации и происходит в процессах нефтепереработки. Эта группа методов нацелена на «создание» ароматического кольца. Наконец, богатейшая химия аренов позволяет проводить синтезы соединений, содержащих ароматическое кольцо, исходя из бензола (реакции алкилирования, ацилирования).
Химические свойства
На основании строения. Наличие π‑системы, как и в случае алкенов, предопределяет реакции бензола с электрофильными реагентами. Однако «двойные» связи обеднены электронной плотностью, поэтому реакционная способность бензола ниже, чем у алкенов. С другой стороны, присоединение электрофила приводит к нарушению сопряженной (объединенной) 6-электронной π‑системы (1 центр выпадает за счёт связывания с электрофилом). Однако выигрыш в энергии при восстановлении ароматической системы настолько велик, что более благоприятным является не присоединение нуклеофила, а отщепление протона, что приводит к продукту замещения, а не присоединения, как в случае алкенов. Таким образом, арены – один из типов нуклеофильных реагентов, в которых нуклеофильные свойства обусловлены наличием π‑системы. Такие нуклеофилы называют «π‑нуклеофилы». Заметим, что электронодонорные заместители, обогащающие ароматическое кольцо электронной плотностью, активизируют процессы электрофильного замещения. Реакции электрофильного замещения включают в себя реакции алкилирования и ацилирования по Фриделю-Крафтсу, галогенирование (в большей степени хлорирование и бромирование, в меньшей степени – иодирование; фторирование нехарактерно (разрушается скелет молекулы)), нитрование и сульфирование. Остальные реакции нами рассматриваться не будут, хотя, конечно, заслуживают внимания. Хотя бы реакция азосочетания – основа химии красителей!
|
|
|
В противоположность реакциям с электрофилами, реакции нуклеофильного замещения для бензола нехарактерны – он сам по себе нуклеофил, а нуклеофил с нуклеофилом не дружат. Тем более, что формально результатом нуклеофильного замещения должно явиться удаление водорода в виде гидрид-иона (H-) – крайне неустойчивой частицы. Ситуация существенно меняется, если в ароматическом кольце присутствует хорошо уходящая группа, хотя бы атом хлора. Тогда под действием сильного нуклеофила (гидроксид-аниона, метилат-аниона) при высокой температуре осуществляется замещение атома хлора на нуклеофильную частицу. Заметим, что электроноакцепторные заместители, уменьшающие электронную плотность в ароматическом кольце, способствуют реакциям нуклеофильного замещения.
|
|
|
Реакции присоединения для бензола нехарактерны и ограничиваются гидрированием (катализатор, давление, нагревание), хлорированием по радикальному механизму (освещение), озонолизом (в этом случае бензол реагирует как циклогексатриен-1,3,5).
Для гомологов бензола легко реализуются разнообразные реакции, затрагивающие положение, соседнее с ароматическим кольцом – бензильное положение. Причина заключается в том, что частица любой природы (катион, радикал, анион), содержащая активный центр в бензильном положении, стабилизирована мезомерным эффектом ароматического кольца (реализуется сопряжение между p-орбиталью атома углерода в бензильном положении и ароматической системой). Следствием этого является относительная лёгкость образования активной частицы именно в бензильном положении (пример 1, пример 6).
Пример 1.
Сравните взаимодействие бензола и метилбензола (толуола) с хлором при освещении.
Решение.
Как Вы знаете, бензол под действием УФ-лучей вступает с хлором в реакцию радикального присоединения. При этом получается 1,2,3,4,5,6-гексахлорциклогексан.
Однако, толуол в тех же условиях реагирует по-другому, а именно по механизму радикального замещения, аналогичному таковому для алканов. При этом происходит замена атомов водорода метильной группы атомами хлора.

Ещё одним следствием является относительная лёгкость окисления гомологов бензола с разрывом углерод-углеродной связи в бензильном положении с образованием бензойных кислот. При этом арены с третичными алкильными группами (например, трет-бутильной) не окисляются (см. пример 6).
Пример 2.
Раскройте механизм реакции бензола с бромом в присутствии опилок железа.
Решение.
Сначала запишем уравнение реакции в общем виде:

Для того, чтобы написать механизм реакции, следует определить, что является активной частицей в этом превращении. Из курса неорганической химии известно, что реакция железных опилок с бромом приводит к бромиду железа (III). Бромид железа (II) образоваться не может, так как в системе присутствует сильный окислитель – бром, который будет окислять железо (II) в железо (III).
2Fe + 3Br2 = 2FeBr3
Образующийся бромид железа (III) представляет собой частицу с вакантной орбиталью, т.е. кислоту Льюиса. Именно эта молекула и является катализатором дальнейшей реакции! Перед Вами один из многих примеров, когда катализатор получают непосредственно в условиях синтеза. Под действием кислоты Льюиса происходит гетеролитический разрыв связи в молекуле брома и образование комплекса брома с кислотой Льюиса, в котором один из атомов брома обладает существенно большим электрофильным характером:
|
|
|
Br2 + FeBr3 = Br+[FeBr4]-
Данный комплекс выступает электрофилом по отношению к молекуле бензола, что приводит к образованию p-комплекса по донорно-акцепторному механизму. Вакантная орбиталь брома предоставлена паре электронов p-системы.

p-комплекс
Следующей стадией является образование s-комплекса, главной особенностью которого является нарушенная ароматичность. При этом один из атомов кольца связывается ковалентно с электрофильной частицей (атом углерода переходит в состояние sp 3 -гибридизации), а заряд «+» оказывается распределён по остальным пяти sp 2 -гибридным атома кольца. Структура s‑комплекса может быть представлена либо структурой с нарушенной ароматичностью (вместо неразрывного кольца изображают пунктир, не включающий sp 3 -гибридный атом) или набором из резонансных структур, отвечающих различному распределению электронов в системе.
 p-комплекс s-комплекс резонансные структуры
p-комплекс s-комплекс резонансные структуры
Каждый метод изображения имеет достоинства и недостатки, поэтому от Вас требуется использовать оба этих метода изображения. Структура с нарушенной ароматичностью правильно передаёт тот факт, что ароматичность в кольце исчезает и стремится восстановиться за счёт отрыва протона, в то время как резонансные структуры показывают преимущественную локализацию положительного заряда, т.е. те положения кольца, которые существенно обеднены p-электронной плотностью.
В отличие от процесса электрофильного присоединения к непредельным углеводородам (алкенам, алкинам, диенам и т.д.) следующей стадией является не присоединение нуклеофильной частицы, а отрыв протона от sp 3 -гибридного атома углерода, что приводит к восстановлению ароматичности. В результате наблюдается замещение протона в ароматическом кольце бензола, поэтому весь процесс носит название электрофильное ароматическое замещение.

Под действием протона происходит частичное разложение комплекса кислоты Льюиса с бромид-анионом: H+ + [FeBr4]- = HBr + FeBr3. К сожалению, обычно образовавшийся комплекс является довольно прочным, поэтому «регенерировать» катализатор не удаётся. По этой причине для реакции требуется эквимольное количество катализатора.

Замечание: большинство реакций электрофильного ароматического замещения необратимы, в том числе, галогенирование. Исключение составляют реакция сульфирования и некоторые реакции алкилирования (введение третичной алкильной группы, из которой образуется устойчивый карбокатион).
Пример 3.
Раскройте механизм реакции толуола с бромом в присутствие железных опилок. Чем объясняется преимущественное образование орто- и пара-замещённых продуктов в этой реакции?
Решение
В основном, аналогично случаю, рассмотренному выше. Точно также, сначала происходит образование катализатора (этот приём называется генерированием in situ, т.е. непосредственно в реакционной массе) – бромида железа (III), кислоты Льюиса, под действием которой происходит гетеролитический разрыв связи в молекуле брома и образование комплекса брома с FeBr3. Этот комплекс выступает электрофильным агентом по отношению к арену (толуолу), что приводит к образованию p-комплекса по донорно-акцепторному механизму.

| 
|
|
| |
|
π-комплекс | |
Наличие метильной группы в ароматическом кольце понижает симметрию молекулы. Вследствие этого возникают 4 возможных направления атаки электрофила с образованием s-комплекса: ипсо -атака на атом углерода C1, орто -атака на атом углерода C2 (C6), мета -атака на атом углерода C3 (С5), пара -атака на атом углерода C4.

| Условимся, что ипсо-атака изначально невыгодна по стерическим причинам, так как любой заместитель имеет объём, больший, чем объём атома водорода, т.е. электрофилу сложнее «дотянуться» до места атаки. Поэтому в дальнейшем мы будем рассматривать только атаку электрофила по орто-, мета-, и пара- положениям ароматического кольца. При этом возникают несколько возможных s-комплексов с нарушенной ароматичностью. | |
|
| ||
| p-комплекс | s-комплекс | |
Обратите внимание на 2 структуры, выделенные жирным шрифтом. Их особенностью является наличие заряда на атоме углерода, непосредственно связанном с заместителем. Нетрудно понять, что именно для этих структур эффект заместителя будет наиболее ярким. Если заместитель «отталкивает» от себя электронную плотность (т.е. обладает донорным эффектом), произойдёт частичное «погашение» положительного заряда, следовательно, увеличится устойчивость частицы и возникнет выигрыш в энергии. Напротив, акцепторные заместители оттягивают электронную плотность на себя, что приводит к обострению дефицита электронной плотности, т.е. к дестабилизации молекулы и проигрышу в энергии. Наиболее неблагоприятной оказывается структура, в которой положительный заряд локализован на атоме углерода, связанном с акцепторным заместителем. Поэтому система стремится любой ценой избежать такого неблагоприятного развития событий, что приводит к преимущественному пути реакции с участием мета -s-комплекса, в котором подобной структуры нет.
Таким образом, на основании рассмотрения электронных эффектов заместителей Вы можете предсказать преимущественное направление электрофильного ароматического замещения: Донорные заместители обогащают ароматическую систему электронной плотностью, что приводит к возрастанию скорости реакции замещённого арена по сравнению с бензолом. При этом замещение преимущественно происходит в орто- и пара- положения к заместителю.
Напротив, акцепторные заместители обедняют ароматическую систему электронной плотностью, что приводит к замедлению скорости реакции замещённого арена по сравнению с бензолом. При этом замещение преимущественно происходит в мета- положение к заместителю.
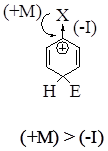
| 
| 
| 
|
| Орто-/пара- ориентанты | Мета-ориентанты | ||
| Активируют ароматическую систему | Дезактивируют ароматическую систему | ||
| NAlk2, OAlk, NHAlk, OH, NH2 | Alk | Галогены: F, Cl, Br, J | COR, COOR, SO3H, CN, NO2 |
| В этом ряду слева направо происходит уменьшение реакционной способности замещённых аренов в реакциях с электрофильными реагентами (E) | |||
Как Вы знаете, метильная группа обладает положительным индуктивным эффектом, следовательно, обогащает ароматическую систему электронной плотностью (донорная группа). Наличие метильной группы значительно понижает энергию s-комплекса (частично компенсирует положительный заряд) при вхождении электрофила в орто- и пара- положения. Таким образом, преимущественно получаются более устойчивые орто- и пара- замещённые s-комплексы. Условно говоря, из 100 молекул толуола 45 (45%) реагируют по пути образования орто -s-комплекса, 50 (50%) – по пути образования пара -s-комплекса и лишь 5 (5%) – по пути образования мета -s-комплекса.
Последней стадией, как уже отмечалось выше, является отрыв протона от s-комплекса с восстановлением ароматичности и образованием продукта замещения.

Соотношение орто- / пара- изомеров в продукте реакции требует специального изучения. С одной стороны, пара- положение более доступно для атаки электрофила, с другой стороны – в молекуле исходного арена вдвое больше атомов водорода, расположенных в орто -положении к заместителю. Соотношение орто- / пара- изомеров зависит от природы исходного арена (заместитель X), природы электрофильного реагента (входящая группа E), температуры (более высокая температура способствует пара- замещению в конкуренции орто- / пара- и мета- замещению (!) в конкуренции мета‑ / пара‑). Поскольку такие вопросы лежат за рамками курса школьной химии, больше останавливаться на них мы не будем. Договоримся лишь, что за счёт подбора условий можно добиться такого соотношения изомеров, при котором из смеси может быть выделен достаточно чистый пара- изомер. Для селективного (избирательного) получения орто- изомера используют метод защитных групп.
Замечание 1. Особо требуется остановиться на ориентирующей способности галогенов. Все атомы галогенов обладают двумя противоположными эффектами, из которых отрицательный индуктивный «перевешивает» положительный мезомерный. Таким образом, галогены дезактивируют ароматическую систему по отношению к электрофильному замещению. Однако мезомерный эффект облегчает электрофильное замещение в орто- / пара- положения за счёт частичной компенсации положительного заряда в одной из резонансных структур s-комплекса, в то время как для замещения в мета- положение такой стабилизации не происходит. Следовательно, галогены являются дезактивирующими орто-/пара-ориентантами.
Замечание 2. Наличие в ароматическом ядре нескольких заместителей. Алгоритм действий очень простой. Отметьте стрелочками «предпочтительную ориентацию» для каждого из имеющихся заместителей. Если направления их действия совпадают, такая ориентация называется согласованной – и реакция будет идти именно по этому центру. В случае несогласованной ориентации следует поступать так: если заместители относятся к разным классам («донор» и «акцептор»), то «разрешает донор». Если в молекуле присутствуют сильный активатор (OR, NR2) и алкильная группа (2 «донора» разной силы), то определяет наиболее «мощный» (OR, NR2). Если же в молекуле присутствуют два акцепторных заместителя с несогласованной ориентацией, то либо реакция приводит к смеси продуктов, либо просто не идёт (так как система сильно дезактивирована).
Замечание 3. Следует помнить об одной простой, но важной закономерности. Реакция электрофильного замещения приводит к появлению в ароматическом кольце нового заместителя, а в реакционной смеси – нового компонента. Как Вы понимаете, продукт реакции также может вступать в дальнейшие превращения под действием реагентов, присутствующих в системе. В большинстве случаев (галогенирование, сульфирование, ацилирование, тем более, нитрование) в ароматическом кольце появляется дезактивирующий заместитель, следовательно, реакционная способность продукта реакции ниже, чем у субстрата. А вот в любимой всеми реакции алкилирования получающийся алкилбензол превосходит по реакционной способности исходное ароматическое соединение (активирующий заместитель). Следовательно, образующийся алкилбензол легче вступает в реакцию электрофильного ароматического замещения. Получающийся диалкилбензол ещё более реакционноспособен, значит, реакция «разгоняется» как снежный ком, собирая на одно ароматическое кольцо всё мыслимое количество алкильных групп. Вывод: реакцию алкилирования необходимо проводить в присутствии большого избытка исходного арена. Это позволит уменьшить, но не исключить, количество образующихся продуктов полиалкилирования. Таким образом, реакция алкилирования Фриделя-Крафтса имеет существенный недостаток.
Качественные реакции.
Решение традиционной задачи. В отличие от алкенов и алкинов, бензол и его гомологи (но не фенол и анилин!) не обесцвечивают бромную воду и подкисленный раствор перманганата калия на холоду. Таким образом, арены демонстрируют сходство с алканами. Отличить гомолог бензола от алкана можно кипячением с кислым раствором перманганата калия: например, таким способом толуол превращают в бензойную кислоту. При этом наблюдается обесцвечивание раствора. Этилбензол превращается в бензойную кислоту и CO2, пропилбензол – в бензойную и уксусную кислоты. А вот бензол даже кипящим раствором перманганата калия не окисляется, поэтому различить бензол и алкан химически довольно сложно.
Ароматичность.
Понятие ароматичности шире, чем понятие об аренах как соединениях общей формулы CnH2n-6. Фактически ароматичность – это явление, при котором наблюдается выровненность связей в сопряжённой системе, сопровождающаяся выигрышем в энергии. Общепризнанной (но не единственной) в настоящее время является теория ароматичности Хюккеля, которая говорит о том, что ароматической является плоская, циклическая, сопряжённая π‑система, содержащая 4 n +2 π‑электрона (n – натуральное число или 0). Таким образом, критерий Хюккеля предсказывает устойчивость бензола (4 n +2,n=1) и неустойчивость циклобутадиена (4 n, n=1). В самом деле, циклобутадиен до сих пор не получен, удалось зафиксировать лишь его димер.
Пример 4.
Какие из перечисленных систем являются ароматическими? Ответ обоснуйте.

Решение.
Проверяем по очереди, удовлетворяет ли система правилу Хюккеля. Система 1 – нет (2×2=4 электрона); 2 – нет (нециклическая); 3 – нет (3×2+2 (заряд «минус»)=8 электронов); 4 – да (плоская, циклическая, сопряжённая, 6 электронов); 5 – да (4 электрона двойных связей и 2 электрона – неподелённая пара атома азота, содержащего метильную группу); 6 – нет (несопряжённая).
Расчётные задачи за Вашу долгую школьную жизнь, Вы, безусловно, решать умеете!
Пример 5.
Смесь бензола, циклогексена и циклогексана при обработке бромной водой присоединяет 16г брома. При каталитическом дегидрировании исходной смеси остаётся 39г бензола и водород, объём которого в 2 раза меньше объёма водорода, необходимого для полного гидрирования исходной смеси. Определите состав смеси (мольных %).
Решение:
Задача по сути математическая, и химии в ней совсем чуть-чуть. Сначала определимся с химическими процессами. Нетрудно сообразить, что бензол с бромной водой даёт …? Правы окажутся те, которые скажут, что бензол с бромной водой не реагирует. Точно также ведёт себя циклогексан (алканы реагируют с бромом по радикальному механизму при высокой температуре или облучении). Таким образом, сразу же можно определить количество циклогексена.

Второе условие посложнее. Из условия следует, что после дегидрирования получается только бензол и водород. Запишем уравнения реакций:

Наконец, последнее условие:

В решении задачи полезно оперировать с количеством вещества. Пусть x – количество бензола, y – количество циклогексена, а z – количество циклогексана. Ответом задачи будут числа x /(x + y + z), y /(x + y + z), z /(x + y + z).
Используем числовые данные. Зная, что в реакции циклогексена с бромной водой израсходовалось 16 г брома, находим, y=0,1 моль.
Используя второе условие, находим количество выделившегося водорода: n1=3z+2y. При этом масса бензола равна mC6H6=78(x+y+z)=39 (1). Используя третье условие, находим объём водорода, необходимый для гидрирования: n2=3x+y. Известно, что n2=2n1. Тогда 3x+y=6z+4y, откуда 3x=6z+0,3 (2). Составляем систему из уравнений (1) и (2) и решаем её: x+z=0,4; 3x=6z+0,3. Нетрудно найти x=0,3; y=0,1; z=0,1. Откуда мольная доля бензола составляет 60%, мольные доли циклогексана и циклогексена – по 20%.
Пример 6
Какое количество перманганата калия потребуется для окисления 12г 1‑фенилпропана?
Решение.
Основная трудность окислительно-восстановительных реакций заключается в подборе коэффициентов. Для их нахождения существуют 2 алгоритма: метод полуреакций и метод электронного баланса.
1-Фенилпропан под действием кислого раствора перманганата калия превращается в смесь бензойной и уксусной кислот. При этом продуктом восстановления перманганата калия является соль двухзарядного катиона марганца.
C6H5CH2CH2CH3 + KMnO4 + H2SO4 =
Метод полуреакций. Для того, чтобы определить коэффициенты, в левую часть записываем формулу 1-фенилпропана, в правую – формулы продуктов реакции. В правой части 4 атома кислорода, поэтому в левую часть добавляем 4 молекулы воды, уравнивая количество атомов кислорода в обеих частях уравнения. Исходя из числа атомов водорода, заключаем, что в левую часть необходимо поместить 10 протонов. Тогда на основании закона сохранения заряда в левую часть необходимо поместить 10 отданных электронов.
Окисление: C6H5CH2CH2CH3 – 10e- + 4H2O = C6H5COOH + CH3COOH + 10H+
Аналогично поступаем со второй полуреакцией. Из перманганата калия получили катион Mn2+. Следовательно, в левую часть необходимо включить 4 молекулы воды. Тогда в правой части оказываются 8 протонов. Из закона сохранения заряда число принятых электронов равно 5.
Восстановление: MnO4- + 5e- + 8H+ = Mn2+ + 4H2O.
Определяем электронный баланс, уравнивая число отданных и принятых электронов. Записываем уравнение реакций с учётом баланса:
C6H5CH2CH2CH3 + 2 KMnO4 + 3 H2SO4=C6H5COOH + CH3COOH + 2 MnSO4 + K2SO4 + 4 H2O.
Метод электронного баланса. Для органических реакций этот метод оказывается более громоздким. Определяем элементы, которые изменили степени окисления. Без труда находим марганец: Mn+7+5e-=Mn+2 (восстановление). Кроме того, степень окисления изменили атомы углерода № 1 и № 2 1-фенилпропана.
C6H5 CH2 CH2CH3 ® C6H5 COOH С-2 – 5e- = C+3 (окисление)
C6H5CH2 CH 2 CH3 ® CH3 COOH С-2 – 5e- = C+3 (окисление)
Степень окисления можно определить следующим образом: изображаем атом углерода, связанный с соседними атомами. Для каждой связи определяем поляризацию и показываем стрелочкой, к какому из атомов смещена общая пара электронов. Степень окисления вычисляем как разность между числом исходящих и приходящих стрелок. Связи углерод-углерод неполярны.
 ст.ок. = 0 – 2= -2
ст.ок. = 0 – 2= -2  ст.ок. = 3 – 0= +3
ст.ок. = 3 – 0= +3
Записываем процессы окисления и восстановления (см. выше). Электронный баланс: уравнение восстановления Mn+7 требуется умножить на 2.
Записываем полное уравнение реакции, помещая коэффициент 2 к формулам, содержащим марганец:
C6H5CH2CH2CH3 + 2 KMnO4 + H2SO4=C6H5COOH + CH3COOH + 2 MnSO4 + K2SO4 + H2O.
Рассчитываем количество серной кислоты по числу SO4-групп в правой части, помещаем к формуле серной кислоты коэффициент «3», затем считаем число атомов водорода и помещаем к формуле воды коэффициент «4».
C6H5CH2CH2CH3 + 2 KMnO4 + 3 H2SO4=C6H5COOH + CH3COOH + 2 MnSO4 + K2SO4 + 4 H2O.
По уравнению реакции на 1 моль 1-фенилпропана расходуется 2 моль перманганата калия. Рассчитываем количество 1-фенилпропана: m = M· v. v = 12г/(77+28+15)г/моль = 12/120 = 0,1 моль. Тогда v (KMnO4)=0,2 моль, т.е. m (KMnO4)=(39+55+64)г/моль·0,2моль = 158·0,2=31,6 г.
|
|
|






