 |
Задания для самостоятельной работы.
|
|
|
|
2.1 Изобразите структурные формулы соединений: а) 2,4,4,6-тетраметилоктан, б) 2,6-диметил-3-этилгептан, в) 3,3,4-триметил-5-этилгептан, г) 2,3,4-триметил-4-изопропилоктан, д) 7-метил-3-этил-4-изопропилдекан.
2.2 Изобразите структурные формулы соединений: а) 2,4,4,7-тетраметилнонан, б) 2,3,6-триметил-4-изопропилгептан, в) 3,4-диметил-3,4-диэтилгексан, г) 3,4,5-триметил-4-этил-гептан, д) 3-метил-5- трет -бутилоктан.
2.3 Изобразите по три структурных изомера гептана с разветвлённым скелетом. Для каждого из соединений предложите название по международной и рациональной номенклатурам, укажите типы атомов углерода. Какой из изображённых изомеров имеет наибольшую (наименьшую) т. кип.?
2.4 Изобразите структурную формулу и назовите по номенклатуре IUPAC алканы с молекулярной формулой C6H14, отвечающие следующим требованиям:
а) в молекуле нет ни третичных, ни четвертичных атомов углерода;
б) в молекуле 2 типа первичных атомов углерода, один тип вторичных и есть третичные атомы углерода;
в) в молекуле 12 первичных атомов водорода, среди которых есть неэквивалентные.
2.5 Изобразите структурную формулу и назовите по номенклатуре IUPAC алканы с молекулярной формулой C6H14, отвечающие следующим требованиям:.
а) в молекуле нет вторичных атомов углерода;
б) изомер имеет наибольшую температуру кипения;
в) в молекуле 4 вторичных атома водорода, которые образуют две пары эквивалентных протонов.
2.6 Изобразите структурную формулу и назовите по номенклатуре IUPAC алканы с молекулярной формулой C7H16, отвечающие следующим требованиям:
а) в несимметричной молекуле 4 первичных, 2 вторичных и 1 четвертичный атом углерода;
б) по рациональной номенклатуре соединение называют метилэтилпропилметаном;
|
|
|
в) при его бромировании образуется одно третичное бромпроизводное. При синтезе этого изомера по реакции Вюрца образуются также октан и 2,3-диметилбутан.
2.7 Определите структурную формулу углеводорода С5H12, при хлорировании которого образуется единственное монохлорпроизводное. Сколько ди- и трихлорпроизводных образуется при дальнейшем хлорировании? Приведите структурные формулы всех моно-, ди- и трихлорпроизводных, назовите их по номенклатуре IUPAC.
2.8 Раскройте механизм реакции:
а) хлорирования бутана; б) сульфирования метилпропана;
в) нитрования изобутана; г) бромирования 2,3-диметилбутана.
2.9 Из 2,2-диэтилбутанкарбоновой кислоты получите 3-бром-2-нитро-3-этилпентан.

2.10 Из 4-метилпентилмагнийбромида (реактива Гриньяра) получите 4,4,5,5-тетраметилоктан.
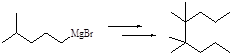
2.11 Из 2-метилгексенкарбоновой кислоты получите соединение предложенной структуры. Примечание: Группа COOH устойчива к восстановлению.
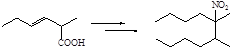
2.12 Из 3-метилциклопентена получите соединение предложенной структуры:

Начала стереохимии.
1. Объясните разницу между понятиями «конфигурация» и «конформация».
2. Какая конформация называется заторможенной? Заслонённой?
3. Какие существуют способы изображения конформаций?
4. Изобразите (качественно!) энергетическую диаграмму вращения этана вокруг углерод-углеродной связи.
5. Изобразите (качественно!) энергетическую диаграмму вращения пропана вокруг углерод-углеродной связи.
6. Изобразите (качественно!) энергетическую диаграмму вращения бутана вокруг углерод-углеродной связи С2-С3.
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
3. АЛКЕНЫ
Алкены – углеводороды общей формулы CnH 2 n (при n ≥ 2), содержащие в молекуле одну двойную связь и составляющие гомологический ряд алкенов. Простейшим алкеном и первым членом этого ряда является этилен (или этен).
|
|
|
Изомерия и номенклатура.
Пример 1.
Назовите по номенклатуре IUPAC алкен, структурная формула которого:

Решение.
Для выполнения заданий по номенклатуре алкенов вспомним некоторые общие принципы построения названий в номенклатуре IUPAC. В качестве главной углеродной цепи выбирается самая длинная, содержащая двойную связь:

Нумерация атомов углерода главной цепи осуществляется так, чтобы атомы углерода при двойной связи получили меньшие номера. Название главной цепи строится по названию алкана с таким же числом атомов углерода заменой суффикса –ан на суффикс –ен и указанием номера атома углерода, после которого расположена двойная связь: гексен-1.
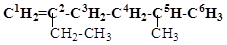
Заместители перечисляются в алфавитном порядке с указанием номеров атомов углерода, с которыми они связаны. Итак, получается название: 5-метил-2-этилгексен-1.
Пример 2.
Изобразите структурную формулу 2-метилбутена-2 и назовите её по рациональной номенклатуре. На примере других изомеров покажите все виды изомерии в алкенах.
Решение.
Структурная формула 2-метилбутена-2:
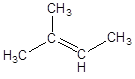
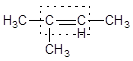
В рациональнойноменклатуре за основу берется молекула простейшего алкена – этилена, и перечисляются заместители. Название по рациональнойноменклатуре: триметилэтилен.
В гомологическом ряду алкенов существуют три вида структурной изомерии:
1) Изомерия углеродного скелета.
Этот вид изомерии можно проиллюстрировать двумя изомерами с молекулярной формулой С5Н10, отличающимися только углеродным скелетом:

2) Изомерия положения функциональной группы (в данном случае – двойной связи).
Этот вид изомерии демонстрируется такими изомерами:
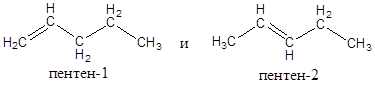
3) Межклассовая изомерия (с классом циклоалканов).
В качестве изомерного циклоалкана С5Н10 можно привести формулу циклопентана:

В алкенах имеется также геометрическая изомерия (вид пространственной изомерии).
Необходимым условием существования геометрических изомеров является наличие разных заместителей у каждого атома С при двойной связи. Так, среди всех алкенов с молекулярной формулой С5Н10 этому условию отвечает только молекула пентена-2:
|
|
|

Механизм.
Разбирая задания по механизму реакций присоединения по двойной связи в алкенах, необходимо отметить то общее, что в них есть: все реакции присоединения (кроме гидрирования) протекают по механизму электрофильного присоединения (AE). Определяющей стадией процесса является атака электрофильной частицей (Е+) электронов π-связи с образованием π-комплекса, переходящего затем в σ-комплекс (или карбокатион), в котором новая σ-связь С-E получается за счет пары π-электронов.
Различия в реакционной способности алкенов разного строения зависят от сравнительной устойчивости образующихся карбокатионов, которая, в свою очередь, определяется электронными эффектами заместителей. Напомним, что алкильные заместители обладают положительным индуктивным (или + I -эффектом), а вопрос о влиянии алкильных заместителей на устойчивость карбокатионов рассматривается в каждом конкретном случае. Присоединение к более устойчивому карбокатиону нуклеофильной частицы, как правило, приводит к получению продукта реакции.
Следует отметить, что присоединение несимметричных молекул HHlg и H2O к несимметричным алкенам протекает по правилу Марковникова: «… водород присоединяется к более гидрогенизированному атому углерода...» (т.е. имеющему большее число атомов водорода). При таком определении правила Марковникова имеются два случая, когда присоединение протекает «против правила»: 1) в присутствии пероксидов (тогда реакция протекает по радикальному механизму) и 2) если хотя бы у одного атома С при двойной связи имеется сильная электроноакцепторная группа. Современное определение правила Марковникова: «реакция присоединения к алкенам протекает по пути образования наиболее устойчивой промежуточной частицы».
Пример 3.
Раскройте механизм реакции присоединения воды к пропену в растворе в присутствии кислоты.
Решение.
Сначала записываем уравнение этой реакции в общем виде:
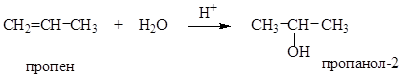
Кислота в этой реакции используется в качестве катализатора и является источником электрофильной частицы – Н+, которая взаимодействует с пропеном с образованием π-комплекса:
|
|
|
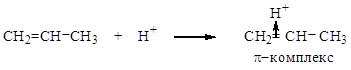
Полученный π-комплекс теоретически может образовать два σ-комплекса:

Алкильные радикалы, являясь электронодонорами, частично «гасят» положительный заряд на атоме С. Только в первом случае такой заместитель – один, а во втором – два, т.е. компенсация «+» происходит сильнее, и второй карбокатион является более устойчивым. Именно он затем реагирует с нуклеофильной частицей – молекулой воды. Дальнейшее отщепление Н+ приводит к продукту реакции: пропанолу-2.

На структурной формуле видно, что присоединение молекулы воды действительно произошло в соответствии с правилом Марковникова, поэтому рассмотрение механизма этой реакции можно рассматривать, как теоретическое обоснование правила Марковникова в современной трактовке.
При письменном ответе на вопрос о механизме реакции достаточно написать несколько строк, например, так:

Способы получения. Химические свойства.
Большинство реакций, в результате которых получают алкены, являются реакциями отщепления (или элиминирования).
Реакции дегидрирования и крекинг алканов протекают неоднозначно, давая смесь многих продуктов, поэтому используются только в промышленности. Основными лабораторными методами получения алкенов являются следующие.
1) Дегалогенирование дигалоидалканов проводят, как правило, действием Zn-пыли (или Mg) на вицинальные (у соседних атомов С) дигалоидалканы.
2) Дегидратация спиртов, т.е. отщепление воды, проводят нагреванием спирта в присутствии минеральных кислот (H2SO4, H3PO4) при 170ºС.
3) Дегидрогалогенирование галоидалканов, т.е. отщепление галогеноводородов, протекает при использовании спиртовых растворов щелочей (NaOH, KOH) при нагревании.
Следует отметить, что строение продуктов реакции в двух последних случаях определяется правилом Зайцева: «… при дегидрогалогенировании галоидалканов и дегидратации спиртов протон отщепляется преимущественно от наименее гидрогенизированного атома углерода…» (имеющего меньшее число атомов водорода).
То обстоятельство, что некоторые окрашенные реагенты, такие, как бромная вода или разбавленный раствор перманганата калия, при взаимодействии с алкенами теряют свою окраску, позволяет использовать эти реакции как качественные в задачах на различение алканов и алкенов.
А последовательное применение реакций присоединения и отщепления двух атомов галогена можно использовать в задачах на разделение алканов и алкенов.
Пример 4.
В сосуде находится смесь двух газов (алкана и алкена). С помощью каких химических реакций можно их разделить и выделить каждый газ в индивидуальном виде?
|
|
|
Решение.
Зная, что при действии Zn (или Mg) в кислой среде отщепление атомов галогена происходит таким образом, что двойная связь образуется именно между атомами С, связанными с атомами галогенов, можно использовать последовательное применение реакций присоединения и элиминирования 2-х атомов галогена для решения различных синтетических задач.
Так, пропускаем исходную смесь газов через бромную воду. Алкен взаимодействует с Br2 с образованием дибромалкана, который растворим в воде и остается в водном растворе.

 R-CH=CH-R’ + Br2 ¾® R–CH–CH–R’
R-CH=CH-R’ + Br2 ¾® R–CH–CH–R’
Br Br
Алкан же проходит через раствор в неизменном виде, и его можно собрать в отдельный сосуд в индивидуальном виде.
К оставшемуся раствору добавляем Zn-пыль. Дибромалкан, находящийся в растворе, реагирует с Zn по реакции:

 R–CH–CH–R’ + Zn ¾® R–CH=CH–R’ + ZnBr2
R–CH–CH–R’ + Zn ¾® R–CH=CH–R’ + ZnBr2
Br Br
Восстановленный[**] алкен выходит из раствора в газообразном виде, и его также можно собрать в отдельный сосуд в индивидуальном виде. Задача решена.
Пример 5.
Определите структурные формулы спиртов, при дегидратации которых можно получить: а) 2-метилбутен-1 и б) 4-метилпентен-2?
Решение.
Реакция дегидратации, приводящая к образованию алкена, - это отщепление молекулы воды от молекулы одноатомного спиртапод действием концентрированной серной кислоты.
а) 2-Метилбутен-1 теоретически можно получить из двух одноатомных спиртов: 2-метилбутанола-1 или 2-метил-бутанола-2.
 Как видно из схемы, отщепить молекулу H2O от второй молекулы спирта можно двумя способами. Однако, для получения искомого алкена такое отщепление происходило бы не по правилу Зайцева (обозначено
Как видно из схемы, отщепить молекулу H2O от второй молекулы спирта можно двумя способами. Однако, для получения искомого алкена такое отщепление происходило бы не по правилу Зайцева (обозначено  ). Элиминирование же молекулы воды по правилу Зайцева (обозначено ) приводит к образованию другого алкена – 2-метилбутена-2.
). Элиминирование же молекулы воды по правилу Зайцева (обозначено ) приводит к образованию другого алкена – 2-метилбутена-2.

Следовательно, 2-метилбутен-1 можно получить только дегидратацией 2-метилбутанола-1.
б) Применяем такой же подход: 4-Метилпентен-2 можно получить из двух одноатомных спиртов: 4-метилпентанола-2 или 2-метилпентанола-3 по схеме:

Из схемы видно, что 4-метилпентен-2 можно получить только дегидратацией 4-метил-пентанола-2 (в соответствии с правилом Зайцева).
Пример 6.
Получите бутен-2 из бутена-1, используя только неорганические реактивы.
Решение.
Реакция присоединения HCl к бутену-1 происходит в соответствии с правилом Марковникова с образованием 2-хлорбутана.

Действие щелочи в спирте на 2-хлорбутан приводит к отщеплению молекулы HCl, которое, протекая по правилу Зайцева, приводит к образованию бутена-2, что и требовалось.
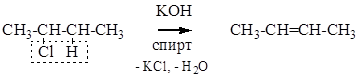
Пример 7.
Этиленовый углеводород массой 7г присоединяет 16г брома. Определите молекулярную формулу исходного углеводорода. Изобразите возможные структурные формулы и назовите их. Напишите реакцию бромирования одного из изомеров и назовите продукт реакции.
Решение.
Название «этиленовый углеводород» означает, что неизвестный углеводород относится к классу алкенов. Общая формула алкенов CnH2n, поэтому задача, по сути, сводится к определению числа n. Реакцию бромирования можно записать в следующем виде:

По условию на 7г алкена расходуется 16г брома. Молярные массы алкена и брома приведены в таблице:


 алкен Br2
алкен Br2
масса (г) 7 16
молярная масса (г/моль) 14n 160
Коэффициенты в уравнении реакции показывают, что соотношение реагентов (исходных веществ) равно 1:1, т.е. количества веществ равны, а именно n(алкена) = n(Br2).
n(алкена) = 7/14n, n(Br2) = 16/160 = 0,1 моль,
Приравниваем 7/14n = 0,1, откуда n = 5, а молекулярная формула алкена C5H10. Изобразить структурные формулы изомеров и назвать их не составит труда.
Пример 8.
При реакции неизвестного алкена с хлором в четыреххлористом углероде образовалось 42,3г дихлоралкана, а при взаимодействии такого же количества исходного углеводорода с бромной водой – 69г дибромпроизводного. Установите молекулярную формулу алкена и возможные структурные формулы.
Решение.
Углеводород класса «алкен» имеет общую формулу CnH2n, и с галогенами вступает в реакцию присоединения по двойной связи с образованием дигалоидалканов. Уравнения этих реакций можно записать следующим образом:
CnH2n + Cl2 ® CnH2nCl2
CnH2n + Br2 ® CnH2nBr2
Поскольку количество исходного алкена в каждой реакции одинаково (по условию задачи), то и количество полученных дигалоидалканов в этих реакциях одинаково, т.е. n(CnH2nCl2) = n(CnH2nBr2). Количество вещества находим по уравнению: n(в-ва) = m(в-ва)/M(в-ва) (1). Массы веществ даны в условии, а молярные массы выражаем так:
М(CnH2nCl2) = 12n + 2n + 35.5×2 = 14n + 71
M(CnH2nBr2) = 12n + 2n + 80×2 = 14n + 160.
Подставляя эти выражения в уравнение (1), получаем следующее уравнение:
42,3/ 14n + 71 = 69/14n + 160.
Решая это уравнение, находим, что n = 4, а молекулярная формула исходного алкена C4H8. Остается изобразить структурные формулы всех изомеров с такой молекулярной формулой, но с этой задачей Вы уже справитесь сами.
Пример 9.
Некий углеводород, главная цепь которого содержит не менее пяти атомов углерода, массой 44,1г способен вступать в реакцию с 8,1мл воды с образованием одноатомного спирта. Определите молекулярную формулу исходного углеводорода. Изобразите все возможные структурные формулы и назовите их. Напишите уравнение реакции.
Решение.
Из условия задачи следует, что исходный углеводород является алкеном: алканы с водой не реагируют, а алкины образуют карбонильные соединения, а не одноатомные спирты. Образование одноатомного спирта означает, что одна молекула углеводорода может присоединить только одну молекулу воды, т.е. он содержит только одну двойную связь и является алкеном. Общая формула алкенов CnH2n.
Реакцию присоединения к алкенам воды можно записать в следующем виде:
CnH2n + H2O ® CnH2n+1OH
Поскольку молярная масса алкена равна 14n, то количество вещества выражаем так: n(алкена) = 44,1/14n.
n(Н2О) = m(Н2О)/M(Н2О) = r(г/мл) ×V(мл) /M(г/моль) = 8,1×1/18 = 0,45 моль
Коэффициенты в уравнении реакции показывают, что соотношение реагентов (исходных веществ) равно 1:1, т.е. количества веществ равны, а именно n(алкена) = n(Н2О). Приравниваем эти величины: 44,1/14n = 0,45, откуда n = 7, а молекулярная формула C7H14.
При изображении структурных формул следует помнить об условии, что главная углеродная цепь содержит не менее пяти атомов углерода. Удачи!
Пример 10.
Смесь этилена и бутана, имеющую плотность по гелию 12,25, подвергли каталитическому гидрированию. Известно, что реакция прошла на 75%. Определите массовые доли веществ в полученной смеси.
Решение.
В начальный момент времени в реакторе находились два газообразных вещества: этилен и бутан. После проведения реакции в состав смеси входят уже три газа: бутан (гидрированию не подвергается), этан (продукт гидрирования этилена) и непрореагировавший этилен.
CH2=CH2 + H2 ¾® CH3-CH3
CH3-CH2-CH2-CH3 + H2 ¾® не идёт
Нам известна плотность смеси газов по гелию до начала реакции. Из определения относительной плотности одного газа по другому (DHe = M(смеси)/MHe) можно выразить M(смеси) = DHe× MHe. С другой стороны, молярная масса смеси двух газов зависит от их мольного соотношения: M(смеси) = M1×x1 + M2×x2, где х1 и х2 – мольные доли двух газов смеси. Очевидно, что х1+х2 = 1, тогда M(смеси) = M1×x1 + M2×(1-x1). Подставим в это уравнение известные величины: 12,25·4 = 28х1 + 58(1-x1). Решая его, получаем: х1= 0,3 – это мольная доля этилена, тогда мольная доля бутана х2 = 0,7.
После проведения реакции мольная доля бутана остается прежней, т.к. суммарное количество газов в ходе реакции не изменяется – из одного моль этилена получается один моль этана, который тоже газ. Мольная доля полученного этана определяется так: х11 = 0,3×0,75 = 0,225, а непрореагировавшего этилена: х12 = 0,3×0,25 = 0,075.
Массы газов в полученной смеси легко рассчитываются по уравнению: mi = Mi×xi; подставляем рассчитанные выше величины и получаем: m(бутана) = 58×0,7 = 40,6 г, m(этана) = 30×0,225 = 6,75 г, m(этилена) = 28×0,075 = 2,1 г и m(смеси) = 49,45 г.
Массовые доли, рассчитанные по уравнению – wi = mi / m(смеси), получаются такими: w(бутана) = 82,1%, w(этана) = 13,7% и w(этилена) = 4,2%.
|
|
|


