 |
Принцип Ле-Шателье – о сопротивлении систем к внешним воздействиям (Но не до конца).
|
|
|
|
Принцип Ле-Шателье гласит что, если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Влияние температуры зависит от знака теплового эффекта реакции. Согласно данному принципу-при повышении температуры, химическое равновесие смещается в направлении эндотермической реакции, а при понижении температуры, в направлении экзотермической реакции. В общем же случае, при изменении температуры, химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры (здесь подразумевается энтропия в определении Гиббса –Дюгема).
Таким образом, при химическом равновесии, в смеси различных веществ, с ростом температуры растет тенденция эндотермического процесса, а с понижением температуры растет тенденция процесса с выделением тепла. Не исключено что, данный принцип, совместно с всемогущим вторым законом, заставил ученых не уйти в сторону безтопливных фантазии. Но давайте посмотрим, что означает сопротивление системы к внешним воздействиям.
Рассмотрим более внимательно конкретный пример, который часто применяется для наглядной демонстрации принципа Ле – Шателье. А именно, равновесный химический процесс образования и распада йодистого водорода.
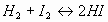 . (3)
. (3)
В соответствии с законами химической кинетики, скорость генерации йодистого водорода зависит от массовой концентрации реагирующих веществ  и
и 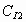
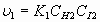 . (4)
. (4)
Вместе с тем, в равновесной системе, постоянно происходит обратный процесс распада йодистого водорода со скоростью
|
|
|
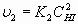 . (5)
. (5)
При этом, в смеси трех веществ, существует динамическое равновесие, что означает существование равенства.
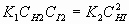 , (7)
, (7)
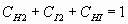 . (8)
. (8)
Допустим, в смеси, извне, вводится дополнительный водород. Следовательно, повысится концентрация водорода  , но снизится
, но снизится 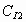 и
и 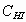 . В результате, скорость прямой реакции
. В результате, скорость прямой реакции  изменится незначительно, а скорость обратной реакции
изменится незначительно, а скорость обратной реакции  снизится заметно. Отмеченное означает снижение скорости образования водорода внутри смеси. Данный процесс является выражением некоторого “протеста” системы против нарушения равновесия и ввода водорода извне. В этом и заключается суть принципа Ле-Шателье. Но, давайте посмотрим, к чему приводит это сопротивление. Несмотря на то, что система старается задержать повышение концентрации водорода, при бесконечном вводе водорода извне, в конечном итоге, получим его полное преобладание. Таким образом, система сопротивляется, но не до конца. Аналогичное случится при вводе других веществ.
снизится заметно. Отмеченное означает снижение скорости образования водорода внутри смеси. Данный процесс является выражением некоторого “протеста” системы против нарушения равновесия и ввода водорода извне. В этом и заключается суть принципа Ле-Шателье. Но, давайте посмотрим, к чему приводит это сопротивление. Несмотря на то, что система старается задержать повышение концентрации водорода, при бесконечном вводе водорода извне, в конечном итоге, получим его полное преобладание. Таким образом, система сопротивляется, но не до конца. Аналогичное случится при вводе других веществ.
Рассмотрим еще один пример процесса, который происходит в двигателях внутреннего сгорания. В начале сжатия, в цилиндре имеем смесь топлива и воздуха. Там же, в некотором количестве, всегда имеются и продукты сгорания. Константа скорости окисления топлива, при низких температурах, является очень низкой, и такая смесь находится в стабильном состоянии. Допустим, смесь сжимается и происходит повышение температуры. В таком случае, согласно принципу Ле-Шателье, должна понизиться интенсивность экзотермического процесса окисления паров топлива кислородом. Но всем известно, что, при чрезмерном повышении температуры, это сопротивление заканчивается взрывом смеси и будет осуществляться бурный экзотермический процесс. Как видим, принцип Ле-Шателье, является справедливым для малых возмущении. При сильных возмущениях процессы могут иметь сложный, нелинейный характер. Сказанное вполне очевидно из системы уравнений равновесия (7, 8), которая не является линейной. Нелинейность процесса еще более растет, когда константа скорости химической реакции меняется сильно, в зависимости от температуры и достигает максимума при приближении к критической температуре 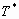 .
.
|
|
|
Таким образом, с ростом температуры смеси топлива и окислителя, в определенных пределах, растет интенсивность эндотермического процесса, но процесс завершается мощным экзотермическим процессом-взрывом.
По аналогии, с понижением температуры продуктов сгорания, в соответствии с Ле-Шателье, должна повыситься интенсивность экзотермического процесса (полное догорание топлива) однако, при чрезмерном снижении температуры, может начаться мощный, обратный, эндотермический процесс. (Конечно, из-за возможности фазовых превращений, при низких температурах, такой процесс можно ожидать не для всех веществ).
Таким образом, для смеси определенных веществ, существует некоторая температура 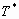 , выше которой не может существовать смесь и могут устойчиво существовать только продукты химической реакции с выделением тепла (продукты сгорания). По полной аналогии, для смеси продуктов сгорания может существовать некоторая минимальная температура -
, выше которой не может существовать смесь и могут устойчиво существовать только продукты химической реакции с выделением тепла (продукты сгорания). По полной аналогии, для смеси продуктов сгорания может существовать некоторая минимальная температура -  , ниже которой может устойчиво протекать только обратный, эндотермический процесс. Интервал между этими температурами можно считать зоной неустойчивого равновесия с соблюдением принципа Ле-Шателье. Равновесие, в данной области, является неустойчивым, так как, смесь исходных продуктов может взорваться до достижения
, ниже которой может устойчиво протекать только обратный, эндотермический процесс. Интервал между этими температурами можно считать зоной неустойчивого равновесия с соблюдением принципа Ле-Шателье. Равновесие, в данной области, является неустойчивым, так как, смесь исходных продуктов может взорваться до достижения 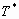 , из-за случайных флуктуации, или искусственно, путем введения искры. Аналогично, в смеси продуктов окисления, по всей видимости, может начаться обратный эндотермический процесс самостоятельно, или путем применения какого либо стимулятора.
, из-за случайных флуктуации, или искусственно, путем введения искры. Аналогично, в смеси продуктов окисления, по всей видимости, может начаться обратный эндотермический процесс самостоятельно, или путем применения какого либо стимулятора.

|
|
|


