 |
Рис.1. Термодинамический цикл преобразователя тепла в работу путем чередования экзотермического (1-2) и эндотермического (3-4) процессов.
|
|
|
|
Рис. 1. Термодинамический цикл преобразователя тепла в работу путем чередования экзотермического (1-2) и эндотермического (3-4) процессов.
Данный постулат не претендует на универсальность но, очевидно, такое соотношение для определенного класса противоположных химических процессов, по всей вероятности, можно считать закономерным.
До настоящего времени, самым распространенным способом распада воды является электролиз, в котором тратят электрическую энергию и такой процесс является экономически не выгодным. Однако не исключено, что при очень низких давлениях, вода будет распадать ниже комнатной температуры, за счет природного тепла и такой процесс будет давать огромную эффективность. Об этом свидетельствуют появившиеся различные сообщения о получении топлива из воды в вихревых машинах, в которых, в условиях кавитации, в паровых пузырьках, достигаются соответствующие параметры для распада воды. Данный процесс был изучен нами теоретически в работе [6, 8].
Для того, чтобы опровергнуть все выше сказанное, сторонникам классической термодинамики придется утверждать, что температуры противоположных химических реакции связаны с температурой окружающей среды. Но не ясно, как могут быть связаны температуры химисческих реакции с температурой планет. Как могут существовать критические пределы, связанные с температурой нашей окружающей среды, когда сама эта температура, в условиях нашей планеты, изменяется в пределах почти 50 градусов и по времени и по пространству.
Нет сомнения, никакой связи между температурой окружающей среды и температурами противоположных химических реакции не существует и - для окончательного разрушения второго закона, следует найти такие конкретные, эффективные эндотермические реакции, которые протекают при, по возможности, низких температурах, чем это нужно для обратных экзотермических процессов.
|
|
|
А теперь покажем что, если температурный интервал экзотермического процесса выше температурного интервала обратного процесса, то можно генерировать энергию за счет тепла окружающей среды, путем непрерывного чередования химических процессов типа (1, 2).
Допустим, внутри цилиндра поршневого двигателя имеем 1 кг смеси топлива и окислителя в газообразном виде, в условиях окружающей среды (точка 0, рис. 1. ). Анализ теплоемкостей различных веществ, которые участвуют в химических реакциях (1. 2) подтверждает, что калорические свойства исходной смеси и продуктов сгорания отличаются не сильно, что позволяет рассмотреть рабочее тело как газ постоянного состава. Для такого газа процесс сгорания имеет эффект подвода тепла извне а эндотермическая реакция вызывает эффект внешнего охлаждения. Для такой системы можно применить анализ в  координатах. При этом, в данном случае, подразумевается не энтропия Гиббса, а энтропия в следующем определении,
координатах. При этом, в данном случае, подразумевается не энтропия Гиббса, а энтропия в следующем определении,
 . (9)
. (9)
В такой системе, для процессов с выделением и поглощением тепла справедливы уравнения
 , (10)
, (10)
 . (11)
. (11)
Где  - тепловой эффект реакции. (
- тепловой эффект реакции. ( 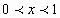 )
)
Путем адиабатного сжатия газа можно повысить его температуру до температуры воспламенения  - или ниже данной температуры (точка 1). В конце сжатия, смесь может воспламениться самостоятельно или искусственно. Если химический процесс протекает в постоянном объеме, то процесс выделения тепла приведет к росту давления и температуры (линия 1-2). Тепло, которое выделяется в данном процессе равняется площади под линией 1-2. Далее продукты экзотермического процесса можно расширить адиабатически, что приведет к падению давления и температуры. Допустим, эндотермическая реакция между продуктами может начаться при температуре
- или ниже данной температуры (точка 1). В конце сжатия, смесь может воспламениться самостоятельно или искусственно. Если химический процесс протекает в постоянном объеме, то процесс выделения тепла приведет к росту давления и температуры (линия 1-2). Тепло, которое выделяется в данном процессе равняется площади под линией 1-2. Далее продукты экзотермического процесса можно расширить адиабатически, что приведет к падению давления и температуры. Допустим, эндотермическая реакция между продуктами может начаться при температуре 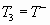 (точка 3). Если данный процесс осуществим в условиях постоянного давления (течение в канале), то температура упадет до T4, а поглощенное тепло будет равняться площади под линией 3-4. В точке 4 будем иметь вновь смесь топлива и окислителя, а давление смеси будет выше атмосферной. Следовательно, смесь можно вновь расширить адиабатически, до давления окружающей среды (точка 5). При этом, температура смеси окажется ниже температуры окружающей среды. Соответственно, если смесь газа проведем в теплообменном аппарате или в потоке воды, то ее температура поднимется до исходной и получим горючую смесь с исходными параметрами (точка 0). Данный цикл дает положительную работу, которая равна площади под линией 5-0. Именно столько тепла забирает рабочее тело от окружающей среды в процессе 5-0. Все остальные процессы протекают в условиях температурной изоляции.
(точка 3). Если данный процесс осуществим в условиях постоянного давления (течение в канале), то температура упадет до T4, а поглощенное тепло будет равняться площади под линией 3-4. В точке 4 будем иметь вновь смесь топлива и окислителя, а давление смеси будет выше атмосферной. Следовательно, смесь можно вновь расширить адиабатически, до давления окружающей среды (точка 5). При этом, температура смеси окажется ниже температуры окружающей среды. Соответственно, если смесь газа проведем в теплообменном аппарате или в потоке воды, то ее температура поднимется до исходной и получим горючую смесь с исходными параметрами (точка 0). Данный цикл дает положительную работу, которая равна площади под линией 5-0. Именно столько тепла забирает рабочее тело от окружающей среды в процессе 5-0. Все остальные процессы протекают в условиях температурной изоляции.
|
|
|
Интересно, что смесь топлива и окислителя, которая применяется немецкими учеными в реакции (1) имеет довольно высокий тепловой эффект. Тепловой эффект 1 кг углеводорода в соответствии с формулой Менделеева равняется  kJ/kg, а в расчете на 1 килограмм смеси составляет
kJ/kg, а в расчете на 1 килограмм смеси составляет  kJ/kg. Изохорное возгорание такой смеси может очень сильно повысить температуру продуктов (выше 8000
kJ/kg. Изохорное возгорание такой смеси может очень сильно повысить температуру продуктов (выше 8000  ). Это свидетельствует о высоком значении ожидаемой мощности. Более точные данные зависят от температурных пределов эндотермического процесса.
). Это свидетельствует о высоком значении ожидаемой мощности. Более точные данные зависят от температурных пределов эндотермического процесса.
|
|
|


