 |
Белки и аминокислоты. 1.Классификация и свойства аминокислот. I. Физико-химическая – основана на различиях в физико-химических свойствах аминокислот.
|
|
|
|
Белки и аминокислоты.
1. Классификация и свойства аминокислот
Аминокислоты (син. аминокарбоновые кислоты) — органические (карбоновые) кислоты, содержащие одну или более аминогрупп; основная структурная часть молекулы белков.
I. Физико-химическая – основана на различиях в физико-химических свойствах аминокислот.
1) Гидрофобные аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы и ароматические кольца. К гидрофобным аминокислотам относятся: глицин, аланин, валин, лейцин, изолейцин, фенилаланин, триптофан, метионин, пролин.
2) Гидрофильные (полярные) незаряженные аминокислоты. Радикалы таких аминокислот содержат в своем составе полярные группировки (-ОН, -SH, -NH2). Эти группы взаимодействуют с дипольными молекулами воды, которые ориентируются вокруг них. К полярным незаряженным относятся серин, треонин, тирозин, цистеин, глутамин, аспаргин.
3) Полярные отрицательно заряженные аминокислоты. К ним относятся аспарагиновая и глутаминовая кислоты.
4) Полярные положительно заряженные аминокислоты: аргинин, лизин и гистидин. Имеют дополнительную аминогруппу в радикале.
II. Биологическая классификация.
1) Незаменимые аминокислоты не могут синтезироваться в организме человека и должны обязательно поступать с пищей валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин
2) аминокислоты относятся к частично незаменимым аргинин, гистидин.
3) Заменимые аминокислоты могут синтезироваться в организме человека глутаминовая кислота, глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин, серин и глицин.
Свойства:
|
|
|
Строение аминокислот. Все аминокислоты являются α -аминокислотами. Аминогруппа общей части всех аминокислот присоединена к α -углеродному атому. Аминокислоты содержат карбоксильную группу –COOH и аминогруппу -NH2. В белке ионогенные группы общей части аминокислот участвуют в образовании пептидной связи, и все свойства белка определяются только свойствами радикалов аминокислот. Аминокислоты амфотерные соединения. Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом.
Аминокислоты – это бесцветные кристаллические вещества, плавящиеся при высоких температурах (> 250°С). Легко растворимы в воде и нерастворимы в органических растворителях. Имея в своем составе NH2–группу основного характера и COOH– с кислыми свойствами, АК обладают амфотерностью. В водных растворах α -АК в основном существуют в виде биполярных ионов или цвиттер-ионов с диссоциированной COO––группой и протонированной NH3+–группой.
В зависимости от рН–среды АК могут быть в виде анионов, катионов, нейтральных биполярных ионов или в виде смеси их форм.
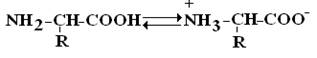
2. Физико-химические свойства белков. Денатурация
1. Молекулярная масса. Белки – высокомолекулярные органические азотсодержащие полимеры, построенные из аминокислот. Молекулярная масса белков зависит от количества аминокислот в каждой субъединице. Масса свыше 6000 Да. Высокая молекулярная масса белков обусловливает их неспособность проходить через полупроницаемые мембраны
2. Многообразие конформации белков при строгой ее специфичности. Поразительная особенность белков состоит в том, что каждый из них имеет четко определенную, присущую только ему трехмерную структуру. Будучи развернутыми или уложенными случайным образом, полипептидные цепи лишены биологической активности. Функциональные свойства белков определяются их конформацией, т. е. пространственным расположением атомов, которое формирует своеобразный рельеф поверхности молекулы белка. Конформация определяется первичной структурой белка, изменение которой приводит к нарушению нативной конформации белка и, следовательно, изменению его функциональных свойств.
|
|
|
3. Динамичность конформации белков. Конформация белка в целом и отдельных участков его поверхности не остается неизменной и характеризуется динамичностью. Важнейшим условием реализации этого свойства является стабилизация структуры белка множеством слабых связей. Динамичность конформации является не столько следствием, сколько важнейшим условием проявления функциональной активности белков.
4. Гидратация и растворимость белков. Большинство глобулярных белков относятся к гидрофильным веществам, хорошо растворяющимся в воде. Это свойство обусловлено расположенными на поверхности белка группами, способными гидратироваться. Под гидратацией понимается связывание диполей воды с ионными и полярными группами белка, такими как -СОО`, -NН3+, -СОNH2, -OH, -SH, в результате чего образуется гидратная оболочка белков (рис. 1. 3). Благодаря этому каждая молекула белка покрывается несколькими молекулярными слоями воды, т. е. одна молекула белка отделена от другой слоем воды и находится в состоянии истинного раствора.
5. Ионизация белка и зависимость заряда от рН среды. Значение рН, при котором число положительных зарядов равно числу отрицательных зарядов, называется изоэлектрической точкой данного белка. В растворах с рН ниже изоэлектрической точки белок приобретает положительный заряд, а выше ИЭТ отрицательный. В ИЭТ точке белки наиболее неустойчивы.
6. Способность радикалов аминокислот в процессе жизнедеятельности подвергаться различным превращениям. В некоторых белках после сборки их полипептидных цепей происходит химическая модификация радикалов некоторых аминокислот с образованием минорных аминокислот.
7. Способность белков к специфическим взаимодействиям с другими веществами основана на том, что связывающий участок белка и взаимодействующее с ним вещество являются комплиментарными друг другу За счет этого достигается безошибочность взаимодействия белков со своим лигандом при условии, что одновременно в клетке происходят миллионы реакций.
|
|
|
8. Способность белков к денатурации. Под денатурацией белка понимают нарушение нативной конформации белковой молекулы, приводящее к уменьшению или полной потере ее растворимости, изменению других физико-химических свойств, утрате специфической биологической активности. Денатурация не сопровождается разрывом пептидных связей и нарушением первичной структуры белка. Происходит расщепление дисульфидных мостиков, гидрофобных, ионных, водородных связей. В результате нарушается третичная структура и в значительной мере вторичная. Денатурацию белка вызывают как физические, так и химические факторы. К физическим денатурирующим факторам относятся: нагревание, ультрафиолетовый свет, высокое давление, механические воздействия, ультразвук. К химическим факторам денатурации относятся: тяжелые металлы, органические растворители, минеральные и органические кислоты, экстремальные значения рН, ионные детергенты.
Можно выделить следующие фазы денатурации: вначале при воздействии денатурирующего агента происходит ослабление внутренних связей, стабилизирующих белковую молекулу, плотность укладки полипептидных цепей уменьшается, внутрь молекулы белка могут проникать молекулы воды - это стадия рыхлого клубка, затем происходит полное развертывание полипептидной цепи белка- это стадия нити, в последующем полипептидная цепь укладывается в пространстве случайным образом, наступает стадия случайного клубка.
Денатурированный белок легче подвергается ферментативному гидролизу, поэтому термические способы обработки пищи способствуют лучшему усвоению пищевых белков. Во многих случаях денатурация является необратимым процессом (белки сваренного яйца). В некоторых случаях при медленном возвращении белка к оптимальным условиям (например, уменьшении концентрации мочевины) возможна его ренатурация. Ренатурация белков в живых организмах не описана. По-видимому, это связано с тем, что денатурированный белок легко расщепляется протеолитическими ферментами.
9. Буферные свойства. Белки – амфотерные полиэлектролиты, т. е. они сочетают в себе кислые и основные свойства. В зависимости от этого белки могут быть кислыми и основными.
|
|
|


