 |
3. Уровни структуры белка. Пептиды– семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединенных в цепь пептидными (амидными) связями -С(О)NН-.
|
|
|
|
3. Уровни структуры белка
Пептиды– семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединенных в цепь пептидными (амидными) связями -С(О)NН-.
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот.
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно.

Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –СО-NH-.

Первичная структура белка - определенная последовательность a-аминокислотных остатков в полипептидной цепи.
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве.
Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).
Вторичная структура белка - конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О.
В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль.
Существует два основных способа укладки цепи.
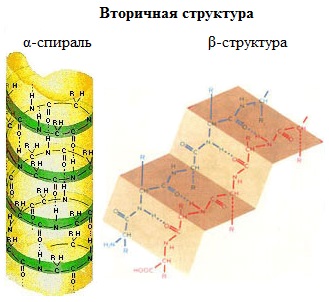
Одна из моделей вторичной структуры - a-спираль. Другая модель – β -форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи.
В α -спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
|
|
|
Основные особенности α -спирали:
· спиральная конфигурация полипептидной цепи, имеющая винтовую симметрию;
· образование водородных связей между пептидными группами каждого первого и четвертого аминокислотных остатков;
· регулярность витков спирали;
· равнозначность всех аминокислотных остатков в α -спирали независимо от строения их боковых радикалов;
· боковые радикалы аминокислот не участвуют в образовании α -спирали.
В β -структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями.
Имеются разновидности β -структур. Ограниченные слоистые участки, образуемые одной полипептидной цепью белка, называют кросс-β -формой (короткая β -структура). Водородные связи в кросс-β -форме образуются между пептидными группами петель полипептидной цепи. Другой тип — полная β -структура — характерен для всей полипептидной цепочки, которая имеет вытянутую форму и удерживается межпептидными водородными связями между смежными параллельными полипептидными цепями (рис. 3). Эта структура напоминает меха аккордеона. Причем возможны варианты β -структур: они могут быть образованы параллельными цепями (N-концы полипептидных цепей направлены в одну и ту же сторону) и антипараллельными (N-концы направлены в разные стороны). Боковые радикалы одного слоя помещаются между боковыми радикалами другого слоя.
Во многих белках одновременно имеются α -спиральные участки и β -структуры. Природных белков, состоящих на 100% из α -спирали, почти не бывает (исключение составляет парамиозин — мышечный белок, на 96-100% представляющий собой α -спираль), тогда как у синтетических полипептидов 100%-ная спирализация.
|
|
|
Другие белки имеют неодинаковую степень спирализации. Высокая частота α -спиральных структур наблюдается у парамиозина, миоглобина, гемоглобина. Напротив, у трипсина, рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые β -структуры. Белки опорных тканей: кератин (белок волос, шерсти), коллаген (белок сухожилий, кожи), фиброин (белок натурального шелка) имеют β -конфигурацию полипептидных цепей.
Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий.
Третичная структура – это трехмерная пространственная конфигурация закрученной α -спирали или β -структуры в пространстве.
Третичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена).
Однако конфигурация третичной структуры белков еще не дает основания думать, что фибриллярные белки имеют только β -структуру, а глобулярные α -спиральные. Есть фибриллярные белки, имеющие спиральную, а не слоисто-складчатую вторичную структуру. Например, α -кератин и парамиозин (белок запирательной мышцы моллюсков), тропомиозины (белки скелетных мышц) относятся к фибриллярным белкам (имеют палочковидную форму), а вторичная структура у них — α -спираль; напротив, в глобулярных белках может быть большое количество β -структур.
Спирализация линейной полипептидной цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь.
Связи, стабилизирующие третичную структуру белка. В стабилизации третичной структуры играют роль связи между боковыми радикалами аминокислот. Эти связи можно разделить на:
· сильные (ковалентные) [показать].
· слабые (полярные и ван-дер-ваальсовы) [показать].
Многочисленные связи между боковыми радикалами аминокислот определяют пространственную конфигурацию белковой молекулы.
|
|
|
У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу».
Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие — от греч. гидро – вода, фобос – страх) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи.
В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп ( солевые мостики) NH3+ и COO— .
Миоглобин
Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами.
Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом.
Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α - и β -цепей и гема.
|
|
|


