 |
Схема строения аллостерического фермента
|
|
|
|
Схема строения аллостерического фермента
В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см " Регуляция активности ферментов" ).
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры).
Основу всех жизненных процессов составляют тысячи химических реакций, катализируемых ферментами. Значение ферментов точно и образно определил И. П. Павлов, назвав их " возбудителями жизни". Нарушения в работе ферментов ведут к возникновению тяжелых заболеваний – фенилкетонурия, гликогенозы, галактоземия, тирозинемия или существенному снижению качества жизни – дислипопротеинемии, гемофилия.
Известно, что для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции. Для характеристики величины энергетического барьера Аррениус ввел понятие энергии активации. Преодоление энергии активации в химической реакции достигается либо увеличением энергии взаимодействующих молекул, например нагреванием, облучением, повышением давления, либо снижением требуемых для реакции затрат энергии (т. е. энергии активации) при помощи катализаторов.

Величина энергии активации с ферментом и без него
По своей функции ферменты являются биологическими катализаторами. Сущность действия ферментов, так же как неорганических катализаторов, заключается:
|
|
|
· в активации молекул реагирующих веществ,
· в разбиении реакции на несколько стадий, энергетический барьер каждой из которых ниже такового общей реакции.
Однако энергетически невозможные реакции ферменты катализировать не будут, они ускоряют только те реакции, которые могут идти в данных условиях.
Сходство и отличия ферментов и неорганических катализаторов
| Сходство | Отличия |
| 1. Катализируют только энергетически возможные реакции. 2. Не изменяют направления реакции. 3. Ускоряют наступление равновесия реакции, но не сдвигают его. 4. Не расходуются в процессе реакции. | 1. Скорость ферментативной реакции намного выше. 2. Высокая специфичность. 3. Мягкие условия работы (внутриклеточные). 4. Возможность регулирования скорости реакции. 5. Скорость ферментативной реакции пропорциональна количеству фермента. |

2. Факторы определяющие активность фермента
Активность ферментов может быть усилена, ослаблена или подавлена за счет влияния ряда факторов (температуры, рН, наличия активаторов и ингибиторов, концентрации субстрата и фермента).
Температура. С повышением температуры скорость всех ферментативных реакций увеличивается. Оптимальная температура для действия большинства животных ферментов находится в интервале 40-50 0С, растительных __ 40-60 °С. При более высоких температурах активность снижается, и многие ферменты разрушаются уже при температуре 70-80 °С. Это явление называется тепловой инактивацией и происходит из-за тепловой денатурации белков. При низких температурах активность ферментов также снижается, но они не разрушаются.
Оптимальная температура не является постоянной величиной, она зависит от длительности температурного воздействия и влажности среды, в которой фермент действует. Ферменты очень чувствительны к нагреванию в присутствии значительного количества воды. И наоборот, при низкой влажности и в сухом состоянии ферменты выдерживают температуру близкую к 100 °С без значительной инактивации.
|
|
|
Влияние рН. Каждый фермент проявляет свое действие в определенных, довольно узких пределах значений рН. Различные ферменты отличаются друг от друга по оптимальным величинам рН. Для большинства гидролитических ферментов оптимум рН находится в интервале 3-6.
Присутствие активаторов и ингибиторов. Активность ферментов зависит от наличия в реакционной среде различных соединений. Вещества, которые повышают каталитическую активность ферментов, называются активаторами. В качестве активаторов могут выступать ионы металлов (натрия, калия, магния, кальция, цинка, меди, марганца, железа) и другие вещества (ионы йода, брома, хлора, SH-группы).
Существуют также соединения (ингибиторы), которые подавляют действие ферментов. Они могут быть общими и специфическими. Общие – это те, которые инактивируют действие всех ферментов. К ним относятся соли тяжелых металлов (свинца, серебра, ртути), трихлоруксусная кислота (ТХУ), танин. Специфические - действуют только на определенную группу ферментов. Для ферментов дыхания и брожения ингибиторами являются галогенсодержащие соединения (хлорацетфенол, йодацетамид и т. д. ).
Различают конкурентное и неконкурентное ингибирование.
Если концентрация молекул ингибитора значительно больше концентрации субстрата, то контактная площадка фермента почти всегда занята ингибитором. В этом случае субстрату некуда разместиться, так как площадка очень мала, и ферментативная реакция не идет.
Если количество молекул субстрата и ингибитора оказывается соизмеримым, то субстрату иногда удается попасть на контактную площадку. В этом случае ферментативная реакция не прекращается, а только замедляется. Скорость ее будет зависеть от количества ингибитора.
В обоих случаях связь ингибитора с ферментом непрочная и такие ингибиторы называются конкурентными.
Ряд ингибиторов, заняв контактную площадку, вступают в химическое взаимодействие с отдельными функциональными группами каталитически активного центра, прочно связываются с ферментом и блокируют его действие. Такой тип ингибирования называется неконкурентным или необратимым.
|
|
|
Существует также аллостерическая (структурно несвязанная) регуляция. В белковой части фермента кроме каталитического центра может находиться аллостерическиий центр, играющий очень важную роль в регуляции ферментативной активности. Данный тип регуляции основан на изменении конформации (пространственной конфигурации) фермента, ведущей к изменению его активности. Аллостерический центр распознает и связывает эффекторы, тем самым, влияя на каталитический центр, изменяя его активность. В качестве эффекторов выступают конечный продукт данной цепи реакций или иные низкомолекулярные вещества. Они отличаются по своей структуре от субстрата. Эффекторы могут быть положительными и отрицательными (соответственно увеличивают или снижают ферментативную активность).
Концентрация субстрата и фермента.
Скорость большинства ферментативных реакций прямо пропорциональна концентрации фермента (рис. 14) в реакционной смеси (концентрация субстрата при этом постоянна).
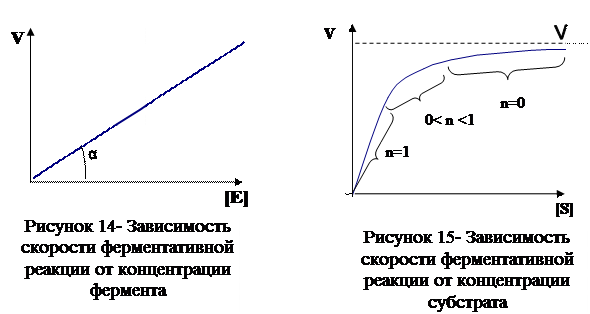 Зависимость скорости реакции от концентрации субстрата (рис. 15) (концентрация фермента неизменна) выражается гиперболической кривой. При низких концентрациях субстрата скорость реакции растет прямо пропорционально его концентрации, при высоких концентрациях __ не зависит от нее. Максимальной скорости реакции можно достичь в случае насыщения активных центров фермента субстратом.
Зависимость скорости реакции от концентрации субстрата (рис. 15) (концентрация фермента неизменна) выражается гиперболической кривой. При низких концентрациях субстрата скорость реакции растет прямо пропорционально его концентрации, при высоких концентрациях __ не зависит от нее. Максимальной скорости реакции можно достичь в случае насыщения активных центров фермента субстратом.
Активность фермента определяется по скорости реакции, которую в свою очередь можно определить либо по убыли субстрата или по количеству продуктов реакции.
3. Регуляция активности ферментов, ингибирование
Вещества, изменяющие активность ферментов, называют регуляторами. Они делятся на ингибиторы, снижающие ферментативную активность, и активаторы, повышающие ферментативную активность. Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. Обратимые ингибиторы связываются с ферментами слабыми нековалентными связями и при определенных условиях легко отделяются от фермента, действуют кратковременно. Обратимые ингибиторы делятся на конкурентные и неконкурентные.
|
|
|
Конкурентные ингибиторы имеют структурное сходство с субстратом, в результате чего возникает конкуренция молекул субстрата и ингибитора за связывание с активным центром фермента. В этом случае с активным центром взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ЕS) или фермент-ингибитор (ЕI). При формировании ЕI комплекса продукт реакции не образуется. Активность фермента может быть восстановлена при повышении концентрации субстрата. Многие лекарственные препараты действуют как конкурентные ингибиторы. Например, сульфаниламиды, обладающие бактериостатическим действием, являются аналогами пара-аминобензойной кислоты, которую бактерии используют для синтеза фолиевой кислоты (необходимой для синтеза нуклеотидов и деления клеток)
Неконкурентные ингибиторы не похожи на субстрат, поэтому взаимодействуют с ферментом в участке, отличном от активного центра.
Необратимые ингибиторы образуют прочные ковалентные связи с ферментом, при этом чаще модификации подвергается активный центр фермента. В результате фермент не может выполнять свою каталитическую функцию. Например, фосфорорганические соединения ковалентно связывают ОН-группу серина, находящуюся в активном центре и играющую ключевую роль в процессе катализа. Такие ингибиторы, если используются как лекарства, действуют длительно (сутки, недели). Восстановление ферментативной активности может быть связано с синтезом новых молекул фермента.
Большинство ферментативных процессов в клетке протекают не в одну стадию, а представляют собой совокупность ферментативных реакций, объединенных в ферментативные цепи (метаболические пути), которые могут быть линейными (гликолиз), разветвленными, циклическими (цикл Кребса). Чтобы воздействовать на скорость метаболического пути, достаточно регулировать количество или активность ферментов. В метаболических путях нет надобности регулировать активность всех ферментов, обычно регулируется активность ключевых ферментов, которые определяют скорость метаболического процесса в целом.
Регуляция скорости ферментативных реакций может осуществляться путем:
· изменения количества молекул фермента,
· доступностью молекул субстрата и кофермента,
|
|
|
· регуляции каталитической активности молекул отдельных ферментов.
Регуляция количества молекул фермента в клетке может осуществляться путем изменения скорости его синтеза (индукция – увеличение скорости синтеза, репрессия – торможение) или путем изменения скорости его распада.
Важный параметр, контролирующий протекание метаболического пути, – наличие субстратов, главным образом – первого, чем больше его концентрация, тем выше скорость метаболического пути.
Регуляция каталитической активности отдельных ферментов . Основными способами регуляции являются: аллостерический и изостерический механизмы, регуляция с помощью белок-белковых взаимодействий, путем химической модификации, ограниченного (частичного) протеолиза.
Изостерическиймеханизм. В этом случае регулятор воздействует непосредственно на активный центр фермента. По такому механизму действуют конкурентные ингибиторы, некоторые металлы.
Аллостеричесий механизм. Многие ферменты помимо активного центра имеют еще и аллостерический центр, пространственно удаленный от активного центра. Аллостерические ферменты обычно являются олигомерными белками, состоящими из нескольких субъединиц. К аллостерическому центру нековалентно присоединяются эффекторы. В их роли могут выступать субстраты, конечные продукты метаболического пути, коферменты, макроэрги (причем АТФ и АДФ действуют как антагонисты: АТФ активирует процессы анаболизма и ингибирует катаболизм, АДФ – наоборот).
Аллостерических центров у фермента может быть несколько. Аллостерические ферменты обладают свойством положительной и отрицательной кооперативности. Взаимодействие эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению формы активного центра, что снижает или увеличивает сродство к субстрату, а значит, соответственно, уменьшает или увеличивает каталитическую активность фермента.
Внутримолекулярное взаимодействие белок – белок (только для олигомерных ферментов) с изменением олигомерности. ПротеинкиназаА – фермент, который фосфорилирует белки за счет АТФ, состоит из 4 субъединиц двух типов: двух субъединиц регуляторных и двух каталитических. Такой тетрамер не обладает каталитической активностью. При диссоциации тетрамерного комплекса освобождаются две каталитические субъединицы и фермент становится активным. Такой механизм регуляции обратим. Ассоциация регуляторных и каталитических субъединиц протенкиназы А вновь приводит к образованию неактивного комплекса.
Регуляция активности ферментов путем химической модификации. Это наиболее часто встречаемый механизм регуляции активности ферментов путем ковалентной модификации аминокислотных остатков. При этом модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами за счет АТФ. Присоединение остатка фосфорной кислоты приводит к изменению каталитической активности, при этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие – становятся менее активными. Изменение активности путем фосфорилирования обратимо. Отщепление остатка фосфорной кислоты осуществляется протенфосфатазами.
Регуляция активности ферментов путем ограниченного протеолиза . Некоторые ферменты синтезируются в виде неактивных предшественников – проферментов и активируются в результате гидролиза одной или нескольких определенных пептидных связей, что приводит к отщеплению части белковой молекулы профермента. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр и фермент становится активным. Отщепление пептида от белков-предшественников катализируют ферменты пептидазы.
При этом активность фермента изменяется необратимо. Ограниченный протеолиз лежит в основе активации протеолитических ферментов ЖКТ, белков свертывающей системы крови и системы фибринолиза, а также белково-пептидных гормонов. Например, трипсиноген, синтезируемый в поджелудочной железе, поступает в кишечник, где на него действует фермент энтеропептидаза. В результате происходит ограниченный протеолиз с отщеплением гексапептида. При этом в оставшейся части молекулы формируется активный центр и образуется активный трипсин.
|
|
|


