 |
1. Предмет биохимии. Задачи. Биохимическое единство. Важные этапы развития биохимии. Уровни организации живой материи
|
|
|
|
1. Предмет биохимии. Задачи. Биохимическое единство. Важные этапы развития биохимии. Уровни организации живой материи
Биохимия – это наука о молекулярной сущности жизни. Она изучает химическую природу веществ, входящих в состав живых организмов, их превращения, а также связь этих превращений с деятельностью клеток, органов, тканей и организма в целом.
Задачи: установление связей между молекулярной структурой и биологической функцией химических компонентов живых организмов.
Уровни организации живой материи:
· Биоэлементы: С, O, H, S, N, P
· Микроэлементы: Fe, Cu, Zn и др.
· Малые органические молекул (масса менее 1 кДа): сахара(глюкоза), жирные кислоты (арахиновая кислота), аминокислоты (глицин), нуклиотиды (адезинодифосфат)
· Макромолекулы (масса равна от 1 до 10-3и более кДа): нуклеиновые кислоты (ДНК и РНК), белки, полисахариды, липиды
Биохимическое единство: Все организмы состоят из одних и тех же соединений примерно в одинаковых пропорциях и эти соединения выполняют вполне определенные общие для всей живой природы функции
Этапы развития биохимической науки:
1. «Протобиохимия». Концепции процессов жизнедеятельности и их природы, развиваемые в древности, античности, в период средневековья. Концепции жизнедеятельности в Эпоху Возрождения, привлечение их для описания и объяснения химических процессов.
2. Экспериментальное изучение процессов жизнедеятельности в 17-18 вв. Первые химические теории и объяснения процессов дыхания, пищеварения, брожения.
3. «Новая химия» и изучение методами химии живых организмов и процесс жизнедеятельности. Первый кризис методологии в области взаимодействия химии и биологии.
4. Формирование биологической химии в рамках редукционистских программ биологии второй половины 19 века.
|
|
|
5. Развитие классической биологической химии.
6. Прогресс биохимии и революция в биологии во второй половине 20 века - формирование физико-химической биологии. Методологические, эмпирические и теоретические основы этого процесса. Интегрирующая роль физико-химической биологии в системе биологических наук.
2. Аминокислоты (структура и классификация). Физико-химические свойства аминокислот. Общность строения, оптическая изомерия, амфотерность, сродство радикалов к воде, изоэлектрическая точка. Заменимые и незаменимые аминокислоты. Химические реакции характерные для аминокислот
 Аминокислоты представляют собой аминопроизводные карбоновых кислот. В природе встречается больше 300 их представителей, 20 из которых являются обязательным структурным компонентом белков. Они определяются как стандартные а/к, 19 стандартных аминокислот соответствует следующей общей формуле:
Аминокислоты представляют собой аминопроизводные карбоновых кислот. В природе встречается больше 300 их представителей, 20 из которых являются обязательным структурным компонентом белков. Они определяются как стандартные а/к, 19 стандартных аминокислот соответствует следующей общей формуле:
где R – аминокислотный радикал.
Структура лишь одной а/к – пролина – не соответствует общей формуле. Это связано с тем, что пролин, собственно, и не является аминокислотой. Он представляет собой иминокислоту.
Классификация: неполярные, незаряженные полярные, положительно заряженные, отрицательно заряженные, ароматические
Ф-Х свойства: в водных растворах существуют в виде биполярных ионов, что обеспечивает высокую растворимость в воде. Относительно высокие температуры плавления (кристаллы обладают ионной решеткой). Амфотерны.
Оптическая изомерия аминокислот
Из структурной формулы, представленной на рисунке, видно, что у всех аминокислот (кроме глицина) к α -атому углерода присоединены 4 разных заместителя (группировки − NH2, − COOH, − H, − R). Такой атом углерода является асимметрическим, поскольку представляет собой центр асимметрии относительно правой и левой стороны.
|
|
|

Для простоты изображения принято обозначать структуру оптических изомеров при помощи проекции на плоскость — в проекционном виде, как на рисунке 1 слева Или еще более простым образом как на рисунке 2 справа:


Номенклатура оптических изомеров аминокислот строится по аналогии с D- и L-глицеральдегидом. Если расположить в плоской проекции главную углеродную цепь аминокислоты по вертикали, чтобы карбоксильная группа была направлена вверх, а радикал (R) — вниз, то аминогруппа будет направлена влево у L-аминокислот и вправо у D-аминокислот.
Амфотерность аминокислот: Наличие в молекуле а/к функциональных групп кислотного и основного характера обусловливает амфотерность а/к. Подобно любому амфотерному соединению, а/к образуют соли как при действии кислоты, так и при действии щелочи. А/к, будучи гетерофункциональными соединениями, должны проявлять свойства как одной, так и другой функциональной группы.


Изоэлектрическая точка
Значение pH, при котором как аминная, так и карбоксильная группы заряжены и эти заряды скомпенсированы, называют изоэлектрической точкой (pl). Ряд а/к не имеет ионогенных групп в боковых химических группировках, в этом случае величина pl равна полусумме pKa аминной и карбоксильной групп. Если же какая-либо а/к содержит дополнительные ионогенные группировки, то при расчете pl следует учитывать их вклад.
Заменимые и незаменимые а/к.
В то время как растения и микроорганизмы могут синтезировать все аминокислоты, млекопитающие в ходе эволюции утратили способность к синтезу примерно половины из 20 протеиногенных аминокислот. Поэтому незаменимые аминокислоты должны поступать с пищей. Так, организм высших организмов не способен синтезировать ароматические а/к de novo (тирозин не является незаменимой аминокислотой только потому, что может образоваться из фенилаланина). К незаменимым аминокислотам принадлежат аминокислоты с разветвленной боковой цепью: валин и изолейцин, а также лейцин, треонин, метионин и лизин. Гистидин и аргинин являются незаменимыми для крыс, но касается ли это также человека — спорно.
Заменимые аминокислоты (аланин, аспарагиновая и глутаминовая кислоты и их амиды, аспарагин и глутамин) образуются в результате трансаминирования из промежуточных метаболитов — 2-кетокислот. Пролин синтезируется в достаточных количествах из глутамата, а представители серинового семейства (серин, глицин и цистеин) сами являются естественными метаболитами организма животных.
|
|
|
Химические реакции характерные для аминокислот
Одной из наиболее характерных реакций аминогруппы является ее взаимодействие с нингидрином:

На этой реакции основано качественное и количественное определение аминокислот как в лабораторной практике, так и промышленных производствах.
·  Ацетилирование аминокислот уксусным ангидридом протекает следующим образом:
Ацетилирование аминокислот уксусным ангидридом протекает следующим образом:
·  Реакции аминогрупп с альдегидами приводят к образованию шиффовых оснований. Реакция протекает по схеме:
Реакции аминогрупп с альдегидами приводят к образованию шиффовых оснований. Реакция протекает по схеме:
·  Большое значение для определения аминокислот в белках и пептидах, в частности концевых аминокислотных остатков, имеет их реакция с 1-фтор- 2, 4-динитробензолом:
Большое значение для определения аминокислот в белках и пептидах, в частности концевых аминокислотных остатков, имеет их реакция с 1-фтор- 2, 4-динитробензолом:
· 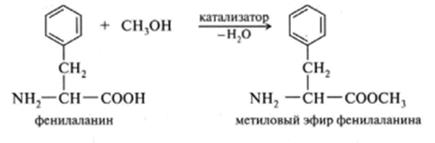 Одной из характерных реакций карбоксильных групп аминокислот является их этерификация:
Одной из характерных реакций карбоксильных групп аминокислот является их этерификация:
|
|
|


