 |
Белки как амфотерные электролиты
|
|
|
|
4. Белки структура и функции. Уровни структурной организации белковых молекул. Типы связей, участвующие в формировании первичной, вторичной, третичной и четвертичной структур. Физико-химические свойства белков. Денатурация белка. Использование процесса денатурации в медицине
Белки – это полимерные молекулы, мономерами которых являются 20 а/к.
Функции: строительная, транспортная, регуляторная, защитная, двигательная, сигнальная, запасающая, энергетическая, каталитическая
4 уровня организации белков:
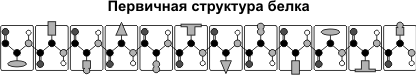 П ервичная структура белка — последовательность расположения а/к остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
П ервичная структура белка — последовательность расположения а/к остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной а/к на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β -субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
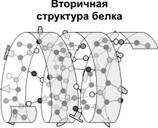 Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
|
|
|
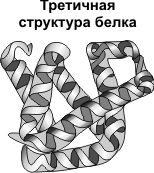 Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
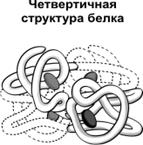
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α -субъединицами (141 аминокислотный остаток) и двумя β -субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Физико-химические свойства: обусловлены составом и количеством входящих в их молекулы остатков аминокислот. Химические свойства белковых молекул разнообразны, включают в себя амфотерность, растворимость, а также способность к денатурации.
|
|
|
Амфотерность. Поскольку в состав белков входят и кислые, и основные а/к, то всегда в составе молекулы будут свободные кислые и основные группы (СОО- и NН3+). Заряд определяется соотношением основных и кислых аминокислотных групп. По этой причине белки заряжены “+”, если уменьшается рН, и наоборот, “-”, если рН увеличивается. В случае, когда рН соответствует изоэлектрической точке, белковая молекула будет иметь нулевой заряд. Амфотерность важна для осуществления биологических функций, одной из которых является поддержание уровня рН в крови.
Растворимость белковых веществ в воде объясняется двумя факторами:
- заряд и взаимное отталкивание белковых молекул;
- формирование гидратной оболочки вокруг белка – диполи воды взаимодействуют с заряженными группами на внешней части глобулы.
Высаливание. Белки обладают свойством обратимого осаждения, т. е. выпадением белка в осадок под действием определенных веществ, после удаления которых он вновь возвращается в свое исходное (нативное) состояние. Для высаливания белков используют соли щелочных и щелочноземельных металлов (наиболее часто в практике используют сульфат натрия и аммония). Эти соли удаляют водную оболочку (вызывают обезвоживание) и снимают заряд.
Ренативация. При определенных условиях денатурированный белок может быть ренативирован (обратимая денатурация). Это происходит при удалении денатурирующего или дестабилизирующего фактора. Например, при удалении мочевины диализом полипептиды самопроизвольно восстанавливают свою нативную конформацию. То же происходит при медленном охлаждении денатурированного нагреванием белка.
Денатурация белка: потеря нативной конформации, утрата спецефической функции белков. (Температура, Интенсивное встряхивание раствора белка, Органические вещества (фенол, этиловый спирт, мочевина, гуанидинхлорид), Кислоты и щелочи, Соли тяжелых металлов, Детергенты – вещества содержащие гидрофобные углеводородный радикал и гидрофильную функциональную группу)
Использование процесса денатурации в медицине: денатурирующие агенты часто применяют для стеилизации медицинского инструмента и материала в автоклавах и в качестве антисептиков для обработки загрязненных поверхностей, содержащих патогенную микрофлору.
|
|
|
5. Белки как амфотерные электролиты. Поведение белков в электрическом поле. Электрофорез. Применение его во врачебной практике. Изоэлектрическая точка белков. Определение суммарного заряда белка.
Белки как амфотерные электролиты
 При изучении хим. состава белка было установлено, что в его молекуле имеются свободные аминные и карбоксильные группы, которые в растворе находятся в виде NH3 и СООН. Следовательно, белки в растворе обладают амфотерными свойствами (амфолит, амфион). При пропускании эл. тока белки будут передвигаться в зависимости от заряда белковой молекулы к катоду или аноду.
При изучении хим. состава белка было установлено, что в его молекуле имеются свободные аминные и карбоксильные группы, которые в растворе находятся в виде NH3 и СООН. Следовательно, белки в растворе обладают амфотерными свойствами (амфолит, амфион). При пропускании эл. тока белки будут передвигаться в зависимости от заряда белковой молекулы к катоду или аноду.
 |
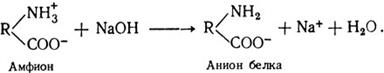 В щелочных растворах белок играет роль аниона: например, при действии едкого натра происходит потеря Н+ из NH+3:
В щелочных растворах белок играет роль аниона: например, при действии едкого натра происходит потеря Н+ из NH+3:
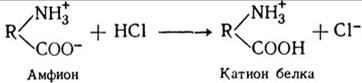
В кислых растворах, наоборот, белок играет роль катиона, как в случае с соляной кислотой:
Т. о., фактором, определяющим поведение белка как аниона или катиона, является значение рН среды. При повышении концентрации водородных ионов (среда кислая - рН 0-7) белок становится катионом, при ее понижении (среда щелочная- рН 7 -14), наоборот, белковые частицы становятся анионами. Такая способность белка проявлять или кислотные, или щелочные свойства характеризует его как амфотерное соединение.
При определенных значениях рН число положительных зарядов белка будет равно числу отрицательных и заряд молекулы в целом будет практически равен нулю. Белковая молекула не будет перемещаться в электрическом поле. При этих условиях белок находится в изоэлектрическом состоянии; рН раствора, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой. Изоэлектрическая точка большинства природных белков лежит в слабокислой среде (рН 4, 8-5, 4). Молекула таких белков содержит больше карбоксильных групп, чем аминных. Это свидетельствует о том, что в их составе содержится больше дикарбоновых аминокислот. В ИКТ белок находится в наименее устойчивом состоянии и при незначительных изменениях рН среды в кислую или щелочную сторону он легко выпадает в осадок.
|
|
|
Так в изоэлектрической точке минимальны электропроводность, устойчивость и набухание белков, а так же вязкость и осмотическое давление растворов белков и максимальны процессы коагуляции и желатинирования.
Электрофорез .
Электрофорез (от электро… и греческого рhoresis – перенесение) – направленное перемещение заряженных частиц в дисперсионной среде под действием внешнего постоянного электрического поля к противоположно заряженному электроду.
Метод позволяет разделять макромолекулы, различающиеся по таким важнейшим параметрам, как
· размеры (или молярная масса),
· пространственная конформация,
· электрический заряд
причем эти параметры могут выступать как порознь, так и в совокупности.
|
|
|


