 |
10. Мультисубстратные реакции (механизм «пинг-понга», последовательный механизм).
|
|
|
|
10. Мультисубстратные реакции (механизм «пинг-понга», последовательный механизм).
Мультисубстратные реакции – это реакции в которых учавствуют 2 (60%всех ферментативных реакций) или более субстратов (крайне редко).
2основных механизма: Механизм «пинг-понга» и Последовательное замещение
1. 
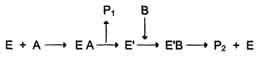 Механизм " пинг-понг". По этому механизму протекают реакции, в которых продукт превращения первого субстрата отщепляется раньше, чем будет связан второй субстрат реакции. Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е') в результате модификации кофермента. Далее к активному центру Е' присоединяется субстрат В, подвергающийся преобразованию в продукт (Р2) с высвобождением нативной формы фермента (Е).
Механизм " пинг-понг". По этому механизму протекают реакции, в которых продукт превращения первого субстрата отщепляется раньше, чем будет связан второй субстрат реакции. Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е') в результате модификации кофермента. Далее к активному центру Е' присоединяется субстрат В, подвергающийся преобразованию в продукт (Р2) с высвобождением нативной формы фермента (Е).
Пример - реакция трансаминирования с участием ферментов аминотрансфераз (кофермент пиридоксальфосфат). Аминотрансферазы, катализируют обратимые реакции переноса аминогруппы с аминокислоты на кетокислоту.
В случае последовательного механизма для протекания ферментной реакции требуется одновременно взаимодействие двух субстратов. В этом случае возможно присоединение субстратов двумя различными путями:
Сначала все субстраты связываются с ферментом, а уже затем происходит сама реакция. Они классифицируются на два подвида:
1. 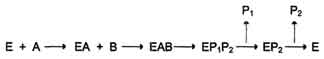 Упорядоченный механизм: связывание субстратов происходит в строго определенном порядке. Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
Упорядоченный механизм: связывание субстратов происходит в строго определенном порядке. Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
Первым в активный центр фермента присоединяется субстрат А, облегчая присоединение субстрата В. После химической модификации также наблюдают определённый порядок высвобождения продуктов реакции.
|
|
|
 E + Пируват + NADH + H+ Е + Лактат + NAD+
E + Пируват + NADH + H+ Е + Лактат + NAD+

2.  Механизм случайного взаимодействия субстрата с активным центром фермента:
Механизм случайного взаимодействия субстрата с активным центром фермента:
Схема. Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет (каждый субстрат имеет свой центр связывания в активном центре). Также нет строгой закономерности высвобождения продуктов реакции.
Примером последовательного упорядоченного механизма может быть реакция дегидрирования с участием коферментов NAD+, NADP+.
Оба кофермента функционируют как посредники переноса двух электронов и одного протона от донора к акцептору, другого протона-в среду (см. схему А)
Донор и акцептор не обязательно участвуют в одном метаболическом пути. Другими словами, восстановленная форма этих нуклеотидов действует как общий пул электронов, образованный в результате окислительных реакций, и может быть использована в различных восстановительных реакциях. Такие реакции называют сопряжёнными (см. схему Б).

Рис. 2-9. Структура (А) и химическое строение (Б) коферментов NAD+ и NADP+.
11. Ингибиторы ферментов. Типы ингибирования. Конкурентное, неконкурентное, аллостерическое ингибирование. Использование ингибиторов ферментов в качестве лекарств.
Ингибиторы ферментов – это вещества, вызывающие частичное (обратимое) или полное торможение реакций, катализируемых ферментами. Ингибиторы обычно принято делить на два больших класса: обратимые и необратимые.
Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп, такой тип ингибирования называется необратимым. Необратимое действие ингибитора в самом простом случае может быть описано уравнением E + I → EI, где Е – фермент; I – ингибитор; EI – ферментигибиторный комплекс. (Примером необратимого ингибирования является действие йодацетата, диизопропилфторфосфата (ДФФ), а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. ) Это действие заключается в cвязывании и выключении функциональных групп или ионов металлов в молекуле фермента.
|
|
|
В случае обратимого действия ингибитор образует с ферментом непрочный комплекс, способный распадаться, в результате чего снова возникает активный фермент. Обратимое действие ингибитора может быть описано уравнением E + I « EI, где Е – фермент; I – ингибитор; EI – комплекс.
Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное, в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата.
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром. Этот тип ингибирования иногда называют ингибированием по типу метаболического антагонизма. Классическим примером подобного типа ингибирования является торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой.
Неконкурентные ингибиторы по своей структуре не родственны субстрату данного фермента; в образовании комплекса с ингибитором в этом случае участвует не активный центр фермента, а какая-нибудь другая часть его молекулы. Образование комплекса влечет изменение глобулярной структуры фермента, и, хотя настоящий субстрат при этом к ферменту все же присоединяется, катализ, тем не менее, невозможен. В качестве примера неконкурентного ингибитора можно привести цианид. Он связывается с ионами металлов, выполняющими у некоторых ферментов роль простетической группы (в частности, с ионами меди цитохромоксидазы), и подавляет активность этих ферментов.
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечёт за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
|
|
|
Некоторые лекарственные вещества,
являющиеся регуляторами активности ферментов
| Группа по фармакологическому действию | Биохимический (физиологический) эффект | Фермент(ы)-мишень | Основные препараты | Показания к применению |
| Нестероидные противовоспалительные | Ингибиторы синтеза простагладинов | Циклооксигеназа (простагландинсинтаза) | Ацетилсалециловая кислота, индометацин, вольтарен, теноксикам и др. | Повышение температуры тела, миалгия, артралгия, невралгия, ревматизм и др. |
| Спазмолитические | Ингибиторы метаболизма циклических нуклеотидов | Фосфодиэстераза цАМФ | Ксантино(компламин), пентоксифиллин(трентал), теобромин и др. | Нарушение периферического кровообращения, ангиопатии, ретинопатии и др. |
| Гипотензивные (антигипертензивные) | Ингибиторы синтеза ангиотензина II. Ингибиторы синтеза катехоламинов | Карбоксидипептидил-пептидаза Дофамин-β -монооксигенназа | Каптоприл, эналоприл, квинаприл Метилдофаза (допегит) | Гипертоническая болезнь (эссенциальная, почечные формы) Гипертаническая болезнь IIА и IIБ стадий |
| Антиагрегационные, антитромботические | Ингибиторы синтеза тромбоксана | тромбоксансинтетаза | Дазоксибен, пирмагрел | Коагулопатии (гиперкоагуляция), тромбоэмболические поражения |
|
|
|


