|
Описание микроскопа и работы с ним. 3 страница
|
|
|
|
Приборы для получения дистиллированной воды.
Дистиллированную воду получают путем перегонки водопроводной воды. Дистилляционный аппарат можно изготовить из колбы (Вюрца), холодильника (Либиха) и приемника воды. Колбу заполняют на 2/з водой, плотно пригоняют пробки. Подогрев осуществляется на электроплитке (через асбестовую сетку) или на водяной бане. Можно использовать для этой цели колбонагреватели. Следует избегать бурного кипения воды, для чего на дно колбы помещают кусочки неглазированного фарфора или несколько стеклянных трубок, запаянных с одного конца. Для получения большого количества дистиллированной воды в лабораториях пользуются аппаратами различных систем — дистилляторами, выпускаемыми промышленностью.
Подготовка лабораторной посуды. Мытье лабораторной посуды имеет существенное значение. Плохо вымытая посуда может быть причиной неправильного результата лабораторных исследований и неудач при культивировании микроорганизмов.
Бывшую в употреблении посуду стерилизуют (авто- клавируют, кипятят), моют горячей водой с мылом, применяя при этом ерши или кусочки фильтровальной бумаги. Вымытую посуду споласкивают дистиллированной водой и высушивают на стенной доске или в сушильном шкафу. Сильно загрязненную посуду (с остатками питательных сред) замачивают в растворе каустической соды на сутки. Для удаления органических веществ применяют эфир, ацетон, бензин, спирт и другие органические растворители. Для очистки стеклянную посуду можно в течение 1—3 сут выдержать в 1%-ном растворе хлорной извести. Затем ее промывают 1%-ным раствором соляной кислоты и споласкивают водой. Высушенную посуду при необходимости стерилизуют.
|
|
|
Особо тщательно готовят лабораторную посуду для культивирования вирусов.
Бывшую в употреблении загрязненную посуду обеззараживают автоклавированием или " химическими веществами (растворы хлорамина, щелочи), затем замачивают в растворе детергентов (ОП-7 или ОП-Ю, тринатрий- фосфат) на 18—20 ч, после чего кипятят 2 ч в щелочном растворе, ершат, промывают дистиллированной водой, нейтрализуют 1 %-ным раствором соляной кислоты, ополаскивают дистиллированной водой. Равномерное стека- ние воды с поверхности сосудов — показатель хорошо
f
вымытой посуды. Если на стенках остаются капли воды, то посуду моют повторно вышеуказанным способом.
Новую посуду моют также, но замачиванию не подвергают.
На предприятиях биологической промышленности и в научно-исследовательских институтах используют специальные машины для мойки лабораторной посуды.
Изготовление ватных пробок для пробирок производится вручную или с помощью специальной машинки. Пробки делают на настольном стекле, которое периоди-, ^ чески овлажняется водой. Берут четырехугольный пласт ваты, расстилают его на стекле ровным слоем, загибают края, туго закручивают валиком и несколько раз прокатывают ладонью по смоченному стеклу. Пробка должна^ быть плотной и соответствовать размерам пробирки. Готовой пробкой считается, если она плотно входит в горлышко сосуда и выдается из него настолько, чтобы ее было удобно захватить рукой; при вытаскивании ее слышен своеобразный звук. Пробку можно обтянуть марлей. , ^
Изготовление пастеровских пипеток. Пастеровские пипетки делают из стеклянной трубки, диаметром 4—7 мм с толщиной стенки 0, 5—1 мм. Для изготовления пипетки берут отрезки трубки длиной около 30 см. Напильником, смоченным водой, или специальным ножом надпиливают стеклянную трубку. Затем трубку кладут на стол так, чтобы надпил совпал с краем стола и ломают ее, легко надавливая на оба конца трубки. Концы трубки оплавляют на пламени примуса или газовой горелки. Затем берут отрезок трубки за концы, помещают серединой в пламя и по мере нагревания равномерно вытягивают в обе стороны до получения перетяжки диаметром 0, 5—1 мм. Затем перетяжку разрывают, тонкий конец пипетки запаивают на пламени (рис. 11). В широкий конец пипетки на глубину до 1 см вкладывают кусочек ваты. Готовые пипетки по 10 шт. завертывают в бумагу и стерилизуют в автоклаве.
|
|
|
Обработка предметных стекол. Предметные стекла должны быть чистыми и хорошо обезжиренными. Контролем чистоты стекла служит капля воды, нанесенная на его поверхность — при достаточном обезжиривании капля расплывается равномерно.
Новые стекла сначала промывают в воде, затем в равной смеси спирта и эфира. Остаток жидкости на стекле
|
|
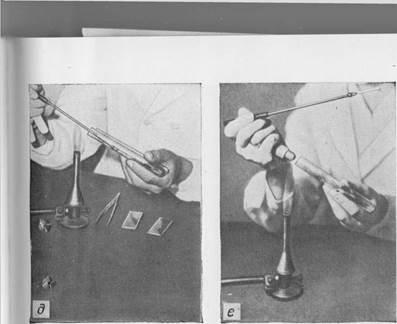
Рис. 6. Приготовление мазков из культур:
а — фламбирование стекла; б — прожигание петли; в — открывание пробирки; г — прожигание края пробирки и петли перед взятием материала;
|
|
| по- ик- них 1о- зу- ди- гу- ые |
|
|
| д — взятие материала; е — закрывание пробирки; ж — изготовление мазка; з — прожигание петли. |
|
|
|
|
|
|
|
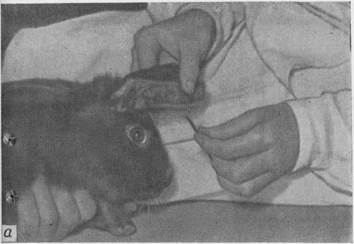
Рис. 13. Внутривенное заражение кроликов: а — краевая вена уха. |
|
|
|
Рис. 14. Взятие крови у лабораторных животных: |
а — из ушной вены у кролика; б ^ из сердца у морской свинки.
|
|
I. Рис. И. Изготовление пастеровских пипеток:
1 а — отрезок стеклянной трубки; б — трубка с перетяжкой посредине; I ( в — трубка с незапаянным капилляром; г — готовая пастеровская пипетка.
удаляют прокаливанием их на пламени. Стекла, бывшие в употреблении, выдерживают 1—2 ч в концентрированной серной кислоте, затем промывают водой, кипятят в* 2%-ном растворе соды или мыльной воде, тщательно споласкивают водой и протирают мягкой полотняной тряпкой.
Простой способ обезжиривания стекол: предметное Истекло хорошо протирают чистым полотенцем, затем тщательно покрывают его сухим хозяйственным мылом и снова хорошо протирают сухим чистым полотенцем до полного исчезновения мыла. Обработанные стекла хранят в банке со спирт-эфиром. Перед употреблением стекла слегка прокаливают на огне.
|
|
|
Замятие 6. ТЕХНИКА ПОСЕВА МИКРОБОВ НА ПИТАТЕЛЬНЫЕ СРЕДЫ И МЕТОДЫ КУЛЬТИВИРОВАНИЯ
Задание. 1. Ознакомиться с техникой посева микробов на простые питательные среды, техникой пересевов и ь& щеления чистых культур.
2. Самостоятельно произвести посевы из патологического материала на МПА и МПБ, а также пересевы культуры с одной среды на другую.
| I с по- [ Мик- 13 них а. По- е изу- |
|
Рис. 16. Работа в боксе с культурой клеток. |
| ращи- ^рату- льные ет со-: твом, ^мпе- ермо- ними водят ювых \ куль- X по |

| Рис 21 Рабочее место ветспециалиста при'прививках животных в хозяйстве. |
| Рис 25. Возбудитель сибирской язвы под микроскопом (мазок из селезенки, окраска на капсулы). |
| чащи- стекла ^орел- iCTBOp т ме- > акте- роста куль- м. _за- роста; иеся оаму, ^ние 'ННОЙ : тои: я с |
3. Ознакомиться с устройством термостата и методами культивирования микробов.
Основное оборудование и материалы. Готовые питательные среды (МПА, МПБ, МГХЖ) в пробирках, агар в колбах для разливания в |актериологические чашки, электроплитки, водяная баня для расплав-
1-1059
ления агара, газовые горелки или спиртовки, бактериологические петли, пастеровские пипетки, резиновая трубка, резиновая груша, каран даши по стеклу, шпатели, скальпели, пинцеты, ванночки. Агар, раа литый заранее в бактериологические чашки. Термостат.
Органы животного, павшего от незаразного заболевания. Можно использовать трупы экспериментально зараженных лабораторных жп вотных. Культура стафилококка или кишечной палочки. Сосуд с до зинфицирующей жидкостью.
Место занятия. Лаборатория техникума.
Методика проведения занятия. Преподаватель демонстрирует тех нику посева из органов трупа на простые питательные среды: МПА, МПБ. Указывает на необходимость соблюдения правил техники безопасности при посевах и пересевах пастеровской пипеткой, отмечает не желательность насасывания материала непосредственно ртом и показы вает как пользоваться при этом резйновой грушей. Обращает внимание учащихся на тщательность прижигания места взятия материал;! для посева. Необходимо показать,, как произвести посев пастеровской пипеткой. и бактериологической петлей. Преподаватель знакомит уча щихся с техникой пересева культуры с одной среды на другую и с методами выделения чистых культур.
|
|
|
Учащихся разбивают на группы по 3 человека. Они самостоятель но производят посевы на МПА и МПБ из органов трупа, пересевы культуры кишечной палочки или стафилококка с одной среды на другую. Затем в бактериологических чашках с заранее разлитым агаром производят штриховые посевы культуры кишечной палочки (вместо обычного МПА можно дать учащимся агар Эндо или бактоагар «Ж»).
В заключение преподаватель знакомит учащихся с методами куль тивирования микробов, объясняет устройство термостата. Посевы, сделанные учащимися, надписывают и помещают в термостат; изучают их на следующем занятии.
Техника посева микробов на питательные среды. Для
выделения культур микробов из патологического материала незначительную часть его с помощью бактериоло- гической петли или пастеровской пипетки вносят на какую-либо питательную среду. Этот процесс называется посевом.
Чтобы произвести посев, бактериологическую петлю или пастеровскую пипетку берут в правую руку между большим, указательным и средним пальцами. Перед посевом бактериологическую петлю или пастеровскую ли- петку прожигают на пламени горелки (тонкий конец пипетки при этом сгибают под прямым углом). Участок органа, из которого будет производиться посев, прижигают непосредственно перед посевом нагретым металлическим шпателем или разрезают стерильным скальпелем (при посеве бактериологической петлей).
В левую руку берут две пробирки с питательными средами — МПБ и МПА. Пробирки удерживают в наклонном положении между большим, указательным и средним пальцами левой руки. Обламывают кончик пастеровской пипетки, быстро проводят пипетку через пламя горелки, прокалывают орган в прижженном месте и насасывают в капилляр пипетки небольшое количество материала. При посеве из печени или селезенки пульпу насасывают движением капилляра вперед и назад, не извлекая капилляра из органа и не прокалывая его насквозь. В целях безопасности при* производстве посевов и пересевов нужно пользоваться резиновой трубкой, один конец которой надевают на пипетку, а на другой надевают резиновую грушу. >
После этого, открывают правой рукой сразу обе пробирки (ватные пробки удерживают между мизинцем и ладонью правой руки), обжигают края пробирок на пламени, вносят пипетку с материалом в пробирку с бульоном, затем быстро насасывают небольшое количество бульона в капилляр и переносят его в пробирку со скошенным МПА. Края пробирок прожигают над огнем, после чего пробирки закрывают ватными пробками, также проведенными через пламя. Использованную пипетку немедленно помещают в сосуд с дезинфицирующей жидкостью, а бактериологическую петлю тщательно прожигают на пламени и помещают в штатив. На пробирках специальным карандашом отмечают наименование органа, откуда был взят патматериал,. номер экспертизы* и дату посева.
|
|
|
Техника пересевов. В левую руку берут две пробирки (пробирку с культурой и со свежей средой), удерживая их большим, указательным и средним пальцами в наклонном положении. МПА должен быть обращен скосом вверх. Пересев осуществляется бактериологической пет-. £! й или пастеровской пипеткой. Петлю прожигают на пламени, пастеровскую пипетку проводят через пламя, сгибают капилляр под прямым углом и обламывают конец его непосредственно перед пересевом.
Над пламенем гореЛки правой рукой открывают сразу обе пробирки, удерживая ватные пробки между мизинцем и ладонью правой руки. Обжигают открытые края пробирок на пламени. Проведенной через пламя петлей или пастеровской пипеткой захватывают небольшое количество материала (петлю нужно предварительно остудить внутри пробирки) и быстро переносят в пробирку со свежей средой. Посевы на МПА осуществляют путем зигзагообразного растирания материала по поверхности среды.
|
|
| 3* |
Посев на мясо-пептонную желатину (МПЖ) производят путем укола платиновой иглой (разогнутой бактериологической петлей) с материалом в центральную часть среды, наблюдая за тем, чтобы игла вошла возможно глубже в среду, но не касалась ее рукояткой. Пробирку с МПЖ держат при этом в перевернутом положении.
После того, как пересев произведен, обжигают края пробирок на пламени, закрывают их пробками, проведенными через пламя. Бактериологическую петлю прожигают и ставят в штатив; использованную пастеровскую) пипетку немедленно помещают в сосуд с дезинфицирующей жидкостью. Пробирку со средой, на которую был произведен пересев, тотчас подписывают.
Выделение чистых культур. При бактериологическим " исследовании микроорганизмы из. учают в чистых культурах, т. е. без примеси других видов микробов. Для выделения чистых культур чаще всего применяют метод дробного посева микробной суспензией на поверхность твердых питательных сред. Используют также метод последовательного разбавления исследуемого материала в жидких или плотных расплавленных средах, а также биологический метод (заражение лабораторных животных).
Перед дробным посевом готовый агар (МПА) в колбах растапливают в кипящей водяной бане и затем стерильно разливают по бактериологическим чашкам. После застывания агара чашки в перевернутом положении ставят на сутки в термостат для проверки на стерильность. При посеве пробирку с микробной суспензией берут в левую руку и удерживают между средним (сверху) и. указательным и безымянным пальцами в наклонном положе,? нии. Открыв пробирку над пламенем предварительно прокаленной петлей захватывают небольшое количество посевного материала. Слегка приподнимают крышку чашки и растирают материал по поверхности питательных сред. При посеве пипеткой предварительно делают из нее шпа* тель (путем сгибания на пламени) и этим шпателем растирают посевной материал. Затем этой же петлей или шпателем (не прожигая их! ) делают посев еще на 2—3 чашки. В этом состоит сущность дробного посева.
После этого петлю прожигают и ставят в штатив; пипетку помещают в сосуд с дезинфицирующей жидкостью. Засеянные чашки надписывают и в перевернутом положении помещают в термостат. Колонии микробов, выросшие на чашках, изучают (при необходимости с помощью лупы или пользуясь малым увеличением Микроскопа), нужные отмечают карандашом, берут из них бактериологической петлей материал для пересева. Получив чистую культуру микробов, приступают к ее изучению.
Методы культивирования микробов. Для выращивания большинства микробов необходима температура 36—37° С. В связи с этим засеянные питательные 4реды помещают в термостат, который представляет собой шкаф, снабженный подогревающим устройством, приспособлением для поддержания постоянной температуры и термометром. Посевы выдерживают в термостате в течение нескольких суток (1—30 сут). За ними ведут наблюдение, а после появления роста производят изучение полученной культуры. Посевы на желатиновых средах выращивают при комнатной температуре.
Занятие 7. ИЗУЧЕНИЕ ПОСЕВОВ, СДЕЛАННЫХ УЧАЩИМИСЯ САМОСТОЯТЕЛЬНО НА ПРЕДЫДУЩЕМ ЗАНЯТИИ
Задание. 1. Изучить и описать характер роста культуры на питательных средах.
2. Из культур изготовить мазки и окрасить их по Граму.
3. Исследовать культуры на подвижность.
Основное оборудование и материалы. Посевы, сделанные учащимися на предыдущем занятии, предметные и покровные стекла, стекла с луночкой, набор красок для окрашивания по Граму, газовые горелки или спиртовки,, бактериологические петли, физиологический раствор з пробирках, микроскопы, иммерсионное масло, вазелин.
Место занятия. Лаборатория техникума.
Методика проведения занятия. Преподаватель кратко излагает методику изучения чистых культур, показывает как исследовать бактерии на подвижность.
Учащиеся самостоятельно оценивают и описывают характер роста з посевах из органов трупа, затем приступают к изучению чистых культур кишечной палочки, пересев которой был сделан на предыдущем ^занятии. Преподаватель обращает внимание учащихся на характер роста кишечной полочки на твердых (колонии) и жидких средах. Учащиеся самостоятельно изготавливают мазки из культур, окрашивают по Граму, проводят микроскопию и зарисовку микрокартины, а в заключение исследуют культуры на подвижность методом висячей и раздавленной капли.
Изучение чистой культуры. После выделения чистой культуры приступают к ее изучению. Оно начинается с описания характера роста микроба на жидких и твердых средах. Изучают чистые культуры, как правило, в суточном возрасте.
Оценка роста на жидких средах сводится к определению степени и характера помутнения, характера осадка, наличия или отсутствия пленки и пристеночного кольца.
Например. Кишечная палочка в первые сутки роста на МПБ вызывает равномерное интенсивное помутнение, на дне пробирки образуется осадок, поднимающийся при встряхивании хлопьями. На поверхности бульона образуется тонкая пленка.
При изучении роста на твердых средах обращают внимание на характер, величину, форму, цвет и прозрачность колоний. Колонии микробов на твердых средах могут быть различной величины и формы. До 1 мм в диаметре колонии считаются точечными или росинчатыми; 1—2 мм — мелкими; 2—4 мм — средними; более 4 мм — крупными. Обращают внимание на края колоний, которые могут быть гладкими или неровными (волнистыми, бахромчатыми, локонообразными). Поверхность колоний также бывает различной — гладкой, морщинистой, исчерченной. Различают колонии и по прозрачности (прозрачные, непрозрачные, матовые); по консистенции (слизистые).
Например. Кишечная палочка образует на МПА в первые сутки роста сочные, слизистые, плоские, серо-белого цвета, средние по размеру, непрозрачные колонии с гладкими краями.
Затем проводят микроскопию культуры, для чего изготовляют мазки и окрашивают их по Граму или другими методами.
Следующим этапом является исследование культуры на подвижность. Для этого используют культуры не старше суточного возраста. Исследование на подвижность проводят с помощью висячей или раздавленной каплиъ
Изготовление висячей капли. Берут специальное стекло с луночкой, тщательно протирают его сухой марлей. Вокруг луночки наносят тонкий слой вазелина. На подготовленное (обезжиренное) покровное стекло наносят каплю культуры. Перед взятием капли из культуры петлю следует хорошо остудить. Каплю по покровному стеклу не растирают, а наносят в одно место. После этого покровное стекло прикрепляют к стеклу о луночкой. Для чего стекло с луночкой переворачивают и местом, где нанесен вазелин, опускают на покровное стекло так, чтобы капля культуры находилась в центре луночки. Затем приготовленный препарат переворачивают таким образом, чтобы покровное стекло было сверху, и исследуют каплю под микроскопом.
При исследовании на подвижность культур, выросших на твердых средах, цредварительно на покровное стекло наносят каплю физраствора и в ней суспендируют культуру, взятую бактериологической петлей с агара.
По окончании исследования препарат снимают с предметного столика микроскопа, осторожно сдвигают покровное стекло так, чтобы оно слегка выступало за край стерла с луночкой, захватывают пинцетом и помещают в сосуд с дезинфицирующей жидкостью.
Изготовление раздавленной капли. На обезжиренное предметное стекло наносят небольшую каплю исследуемой культуры и накрывают ее покровным стеклом.
Исследование приготовленных препаратов производят следующим образом. Уменьшают отверстие диафрагмы микроскопа или несколько опускают конденсатор. Пользуясь объективом 8Х, отыскивают край капли, затем не сдвигая препарата, исследуют его с помощью объектива 40X. В, случае необходимости можно исследовать препарат и в иммерсионной системе, для чего наносят на покровное стекло каплю масла и осторожно под контролем глаза опускают в него объектив. Характер и степень подвижности у различных микробов могут быть разными. Подвижность может быть хорошо-, средне- и слабовыраженной.
Дальнейшее исследование чистой культуры проводят путем пересевов на специальные питательные среды (цветной ряд, элективные среды — агар Эндо и т. п. ) для изучения биохимических свойств, способности к пигмен- т^рбразованию, гемолитических свойств и пр. При необходимости проводят серологические исследования выделенной культуры и заражают лабораторных животных.
К концу исследования должны быть четкие данные о морфологических, культуральных, биохимических, серологических свойствах и патогенности изучаемой культуры, на основании которых определяют данный вид микроорганизмов, используя для этой цели специальные таблицы или определители микробов.
Занятие 8. ПРАВИЛА РАБОТЫ С ЛАБОРАТОРНЫМИ ЖИВОТНЫМИ
Задание. 1. Подготовить инструменты и материалы для заражения лабораторных животных.
2. Изучить приемы фиксации лабораторных животных, измерить температуру у кролика и морской свинки.
3. Заразить различными способами кролика, морскую свинку, белую мышь, голубя.
4. Вскрыть трупы кролика, морской свинки, белой мыши, голубя.
5. Ознакомиться с методикой взятия крови у лабораторных животных.
Основное оборудование и материалы. Лабораторные животные: кролики, морские свинки, белые мыши, голуби. Трупы убитых лабораторных животных. Эфир или хлороформ, стеклянный колпак. ГЙпри- цы I—2-граммовые с иглами, стерильные тампоны, стерилизаторы, термометры, пинцеты, ножницы, скальпели, кюветы, залитые воском, или доски для фиксации трупов, тазики или подносы, булавки для фиксации трупов, электроплитка, газовая горелка или примус, спирт, вата, кровоостанавливающие пинцеты (Пеана или Кохера). 2%-ный раствор фенола. Спиртовки. Свободные клетки или стеклянные^банки для зараженных животных. Культуры кишечной палочки. Стерильные ступки с пестиками для приготовления суспензий, физиологический раствор в колбах, пробирки для взятия крови (размером 14x65 мм). Бумага для этикеток. Краска для мечения животных.
Место занятия. Лаборатория техникума.
Методика проведения занятия. Преподаватель демонстрирует способы фиксации лабораторных животных; объясняет, как правильно приготовить инструмент и материал для заражения; показывает различные способы заражения животных.
Учащиеся самостоятельно готовят инструмент и материал для заражения (суспензии, культуры), измеряют температуру у кроликов и морских свинок, заражают различными способами лабораторных животных. Вместо культуры учащимся можно дать стерильный физраствор. После заражения учащиеся метят животных, помещают их в свободные клетки, надписывают клетки или банки, стерилизуют jyrjhi- ботанный- инструмент.
Преподаватель показывает как нужно вскрывать трупы лабораторных животных. Учащиеся самостоятельно вскрывают трупы нескольких лабораторных животных (можно тут же на занятиях убить эфиром нескольких животных), описывают патологоанатомические изменения, наблюдаемые при вскрытии. В заключение преподаватель знакомит учащихся с методикой взятия крови у кроликов и морских свинок.
Работа с лабораторными^ животными. Лабораторные животные служат для выявления возбудителя инфекции в исследуемом материале, определения патогенности и вирулентности изучаемого микроба, выделения чистых культур из смеси с сапрофитами, изготовления различных компонентов, применяемых в серологических исследованиях (комплемент, сыворотки и т. п. ), культивирования некоторых микробов.
В лабораторной практике широко применяют кроликов, морских свинок, белых крыс, белых мышей и голубей. При использовании того или иного вида животных учитывают степень чувствительности к нему возбудителей определенных инфекционных болезней (например, голубь очень чувствителен к заражению возбудителем рожи свиней).
Животные, предназначенные для заражения, должны быть здоровыми, иметь хорошую упитанность, гладкую, блестящую шерсть, нормальную температуру тела. Измеряют температуру тела у морских свинок и кроликов обычным термометром. Показания термометра зависят Ът глубины его введения в прямую кишку. Поэтому, чтобы получать сравнимые результаты, необходимо вводить термометр на одну и ту же глубину, для чего надевают на термометр на определенном расстоянии от его конца резиновое кольцо. Повторные измерения температуры тела необходимо производить в одни и те же часы.
Перед заражением животных метят, взвешивают, определяют пол (при необходимости). Обычно в лаборатории метят животных окрашиванием различных частей тела анилиновыми красками (лучше всего использовать для этой цели карболовый фуксин Циля, метка фуксином хорошо заметна и держится в течение 1—2 мес) или при помощи металлических бирок или татуировочных щипцов.
Инструмент для заражения (шприцы 1—2-граммовые, иглы, пинцеты и, т. п. ) кипятят в дистиллированной воде 10—20 мин. Следует обратить особое внимание щ на подгонку поршне^ шприцев, а также на подгонку игл к шприцам. Нельзя пользоваться неисправными шприцами и плохо подогнанными иглами.
Одновременно подготавливают все необходимое для заражения: спирт, вату, этикетки для клеток с заражен- ♦ ными животными, заранее простерйлизованные маленькие тампоны с ватой, которые служат для выпускания воздуха из шприца при заражении животных. Изготавливают их из куска бумаги размером 7х 10 см„ в который завертывают небольшой кусочек ваты (по типу того, как расфасовываются порошки с медикаментами). Изготовленные таким образом пакетики стерилизуют в автоклаве. Перед заражением такой пакетик надевают на иглу, шприц (с культурой микробов или суспензией)
держат вертикально (иглой вверх) и легким движением поршня удаляют из цилиндра воздух, без риска инфицировать заразным материалом окружающие предметы. После работы инструменты вновь кипятят в дистиллированной воде 20—30 мин.
Для заражения лабораторных животных служит культура микробов или суспензия из присланного на исследование материала. Обычно заражение производят суточными бульонными или агаровыми культурами. С агаровой культуры делают смыв, для чего к ней стериль-^ но добавляют несколько миллилитров стерильного физ-* раствора и, вращая пробирку между ладонями, смывают с агара микробную культуру. Отдельные колонии снимают с агара петлей и суспендируют микробов в неболь^ шом количестве стерильного физраствора.
Суспензию вводят животным сразу или после предварительной фильтрации через ватно-марлевый фильтр. Сыворотку, кровь, экссудаты вводят животным без предварительной обработки.
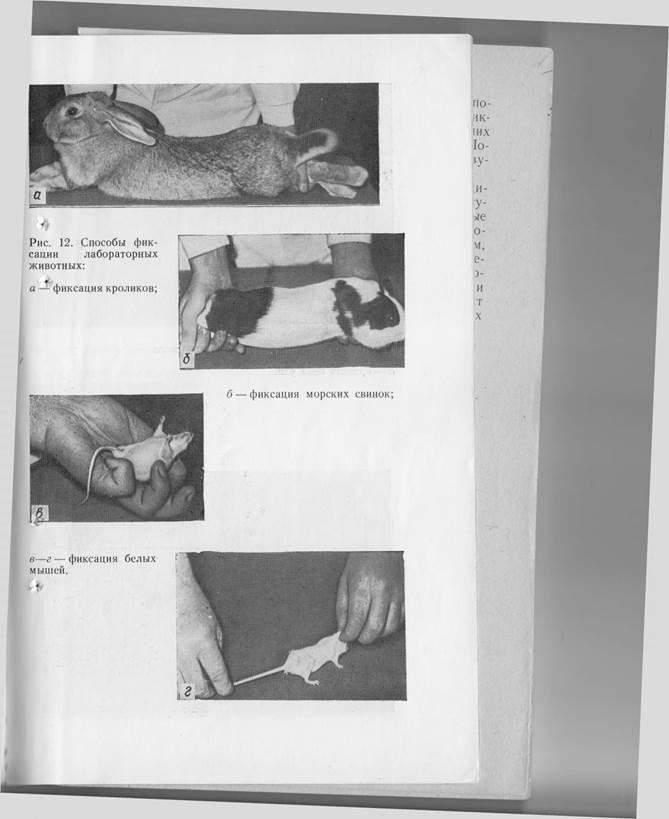
Способы фиксации лабораторных животных. Из клетки -кролика извлекают за кожную складку на спине и помещают на стол (за уши брать кроликов не следует). Подводят руку под живот и захватывают обе задние конечности (возможно выше), затем приподнимают кролика за задние конечности, а другой рукой фиксируют обе передние конечности. После этого кролика снимают со стола и растягивают во всю длину (рис. 12, а).
При введении материала внутривенно или при взятии крови из ушной вены кролика удобнее всего заворачивать (пеленать) в кусок плотного материала, оставляя свободной только голову.
|
|
|