 |
Средняя энергия осциллятора
|
|
|
|
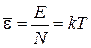 .
.
Каноническое распределение
Объект – равновесный идеальный газ из N частиц в объеме V в термостате с температурой Т.
Вывод функции распределения микросостояний
По фазовому пространству
Идеальный газ – любые подсистемы независимы, энергия их взаимодействия друг с другом равна нулю.
Систему делим на подсистемы 1 и 2, тогда
 .
.
По теореме Лиувилля распределения для подсистем и для всей системы выражаются через соответствующие гамильтонианы
 ,
,
 ,
,
 .
.
По теореме об умножении вероятностей независимых событий распределения связаны между собой
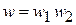 ,
,
тогда
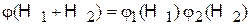 .
.
Логарифмируем
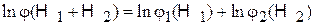 ,
,
берем дифференциал
 ,
,
где  .
.
Учитываем, что  и
и 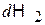 – независимые величины, тогда
– независимые величины, тогда
 .
.
В результате получаем
 ,
,
k – постоянная Больцмана, смысл T устанавливается далее. Следовательно:
 – универсальная функция,
– универсальная функция,
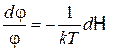 .
.
Интегрируем
 .
.
Полагаем  , как показано далее
, как показано далее  – свободная энергия системы.
– свободная энергия системы.
Получаем каноническое распределение
 (2.15)
(2.15)
– вероятность обнаружения микросостояния в единице объема фазового пространства около точкиX,
 (2.15а)
(2.15а)
– вероятность обнаружения микросостояния в объеме dX фазового пространства около точкиX.
Статистический интеграл системы Z
Полагаем  ,
,
 ,
,
 . (2.16)
. (2.16)
Условие нормировки

дает макрохарактеристику – статистический интеграл системы
 . (2.17)
. (2.17)
Статистический интеграл частицы 
Для идеального газа из N тождественных частиц
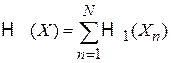 ,
,
 ,
,
 – гамильтониан частицы n.
– гамильтониан частицы n.
С учетом  интеграл (2.17) распадается на произведение N одинаковых интегралов. Получаем выражение стат. интеграла системы через стат. интеграл одной частицы
интеграл (2.17) распадается на произведение N одинаковых интегралов. Получаем выражение стат. интеграла системы через стат. интеграл одной частицы
|
|
|
 , (2.18)
, (2.18)
где макрохарактеристика – статистический интеграл частицы
 , (2.19)
, (2.19)
 .
.
Для независимых видов движения частицы: поступательного, вращательного, колебательного и внутреннего
H1 = (Hпост)1 + (Hвращ)1 + (Hколеб)1+ (Hвнутр)1,
тогда
 . (2.20)
. (2.20)
Для N частиц
 . (2.21)
. (2.21)
Далее получено
 , (2.22)
, (2.22)
для двухатомной молекулы с моментом инерции J и частотой собственных колебаний w
 ,
,
 . (2.23)
. (2.23)
Физический смысл T
Общее начало термодинамики –если температуры систем одинаковые, то тепловой контакт не изменяет их макросостояний.
До контакта
 ,
,  . (2.16)
. (2.16)
В момент контакта в силу независимости систем их общее распределение
 .
.
С течением времени гамильтонианы изменяются, их сумма сохраняется. Распределение не меняется, если  . Следовательно, Т – температура.
. Следовательно, Т – температура.
Распределение микросостояний по энергии
Состояния с энергией Е находятся в фазовом пространстве на гиперповерхности  . Изменение энергии на dE вызывает переход к соседней гиперповерхности и ее объем меняется на dX, причем
. Изменение энергии на dE вызывает переход к соседней гиперповерхности и ее объем меняется на dX, причем
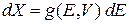 , (2.9а)
, (2.9а)
где  – энергетическая плотность состояний. В каноническом распределении (2.15) и (2.16)
– энергетическая плотность состояний. В каноническом распределении (2.15) и (2.16)
 ,
,
переходим от переменных X и H к переменной Е. Получаем
 (2.24)
(2.24)
– вероятность обнаружения микросостояний с энергией в интервале 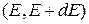 .
.
Свободная энергия и статистический интеграл
Из (2.24) получаем соотношение между свободной энергией F и статистическим интегралом Z
 ,
,
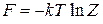 . (2.25)
. (2.25)
Внутренняя энергия U и статистический интеграл
Внутренняя энергия является средним значением полной энергии системы
 .
.
Из (2.16) и (2.17)
 , ,

|
находим
 ,
,
где использовано
 .
.
Учитываем
 ,
,
получаем выражение внутренней энергии через статистический интеграл
 . (2.26)
. (2.26)
Уравнение Гиббса–Гельмгольца
|
|
|
Исключим статистический интеграл из (2.25) и (2.26), и найдем соотношение между внутренней энергией и свободной энергией, которое называется в термодинамике уравнением Гиббса–Гельмгольца.
Выражение
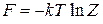 . (2.25)
. (2.25)
в виде

подставляем в (2.26) и выражаем внутреннюю энергию через свободную энергию
 (2.27)
(2.27)
– уравнение Гиббса–Гельмгольца. Следовательно, в (2.25) F – свободная энергия.
Из первого равенства в (2.27) получаем
 .
.
Интегрируем
 . (2.28)
. (2.28)
В результате свободная энергия выражена через внутреннюю энергию.
Смысл свободной энергии
Является термодинамическим потенциалом – не зависит от пути перехода между начальным и конечным состояниями.
Является полным дифференциалом своих аргументов
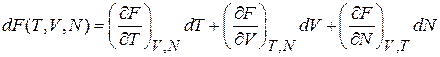 . (2.30а)
. (2.30а)
В термодинамике известно соотношение
 . (2.31)
. (2.31)
Берем дифференциал
 . (2.31а)
. (2.31а)
Для равновесного, обратимого процесса используем
 ,
,
 ,
,
тогда
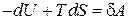 ,
,
и из (2.31а) при  получаем
получаем
 .
.
Следовательно, свободная энергия является частью внутренней энергии, которая при изотермическом процессе переходит в работу.
Связанная энергия

– часть внутренней энергии, которая при изотермическом процессе не может быть превращена в работу и выделяется в виде теплоты.
Понятия свободной и связанной энергий ввел Герман Гельмгольц в 1847 г.
|
|
|


