 |
32. Методы очистки химических реактивов.
|
|
|
|
32. МЕТОДЫ ОЧИСТКИ ХИМИЧЕСКИХ РЕАКТИВОВ.
Очистка методом перекристаллизации
Перекристаллизация применяется для очистки различных растворимых солей и многих твердых органических веществ. Перекристаллизация – один из наиболее распространенных методов очистки и разделения кристаллических веществ. Этот метод основан на различной растворимости вещества в холодном и горячем растворителе и на различной растворимости компонентов смеси в одном и том же растворителе.
Процесс перекристаллизации включает в себя несколько стадий:
1. Выбор растворителя. Выбор проводится опытным путем. Растворитель должен отвечать следующим требованиям:
1) не взаимодействовать с веществом,
2) не растворять вещество при комнатной температуре и хорошо растворять при нагревании,
3) при охлаждении горячего раствора должны выпадать кристаллы,
4) хорошо растворять примеси при комнатной температуре или не растворять их при кипячении,
5) температура кипения растворителя должна быть ниже температуры плавления вещества на 10-15º С,
6) растворитель должен легко удаляться с поверхности кристаллов при промывании и сушке.
2. Приготовление насыщенного при температуре кипения растворителя раствора.
3. Фильтрование горячего раствора через складчатый фильтр для избавления от механических примесей.
4. Охлаждение раствора, вызывающее кристаллизацию. Охлаждение ведут с такой скоростью, чтобы выпадали кристаллы средних размеров. Обычно раствор оставляют стоять при комнатной температуре 20-30 минут, а затем помещают в ледяную баню. Если кристаллы не выпадают, то можно поместить в раствор кристаллик данного вещества («затравку») или потереть стеклянной палочкой о внутреннюю стенку стакана с раствором.
|
|
|
5. Отделение кристаллов от маточного раствора (фильтрование при пониженном давлении).
6. Промывание кристаллов холодным растворителем. Если при комнатной температуре вещество практически не растворимо, то кристаллы можно промывать растворителем комнатной температуры.
7. Сушка кристаллов. Сушат кристаллы обычно на воздухе или в вакуумном кристаллизатор.
Обезвоживание органических реактивов.
При работе в лаборатории часто приходится очищать различные растворители (спирт, эфир, бензол и др. ). Все эти реактивы содержат воду в том или ином количестве, присутствие которой может мешать работе. Поэтому эти реактивы, прежде чем перегонять, высушивают. Очищенные таким образом жидкости называются абсолютными. Поскольку органические реактивы обладают разными свойствами, способы их высушивания различны.
Абсолютирование спирта.
Для высушивания спирта в круглодонную колбу помещают обезвоженный сульфат меди CuSO4 и наливают спирт. Колбу подключают к обратному холодильнику, который закрывают пробкой с хлоркальциевой трубкой. В хлоркальциевую трубку помещают прокаленный хлорид кальция для поглощения паров воды из воздуха. Прибор устанавливают на водяной бане и кипятят в течение 6-8 часов. По окончании кипячения обратный холодильник заменяют холодильником Либиха и спирт перегоняют в чистую колбу. Прибор во время перегонки тщательно защищают от попадания влаги воздуха.
33. Правила приготовления растворов солей разной концентрации.
1. Все водные растворы следует готовить только на дистиллированной воде. При приготовлении водных растворов солей заданной концентрации нужно учитывать также кристаллизационную воду.
2. Приготовляя точные растворы, нельзя наливать в мерную колбу сразу всё нужное количество воды.
3. Мерные колбы калиброваны на определённый объём лишь при температуре, указанной на колбе. Поэтому точный объём жидкости можно получить только при стандартной температуре.
|
|
|
4. Так как приготовить растворы точно заданной концентрации трудно, то прежде чем пользоваться раствором, надо установить его концентрацию или поправку на нормальность.
5. Необходимо наклеивать этикетки (или делать надпись специальным карандашом) на сосудах с растворами.
6. Все растворы следует готовить только в хорошо вымытой посуде. Надо заботиться о том, чтобы приготовленные растворы не загрязнялись каким-либо образом. Нельзя путать пробки от посуды, содержащей растворы разных веществ.
7. Растворы, которые могут портиться от действия света, как марганцевокислый калий, азотнокислое серебро и др., нужно хранить только в тёмных склянках. Для некоторых веществ можно употреблять жёлтые склянки, для других же сосуды необходимо оклеивать чёрной бумагой, но не покрывать стекло черным лаком: лаковая пленка всегда немного пропускает свет. Если черной бумаги нет, бутыль или другой сосуд следует оклеить плотной бумагой и бумагу покрыть черным лаком.
8. Растворы щелочей нужно хранить так, чтобы на них не действовала двуокись углерода. Для этого в пробку вставляют хлоркальциевую трубку, наполненную натронной известью или другим твёрдым поглотителем двуокиси углерода.
9. Растворы щелочей следует готовить вначале очень концентрированными и разбавлять их до нужной концентрации только после отстаивания и фильтрования.
10. Надо быть осторожным с растворами, которые могут вредно действовать на кожу рук, одежду или обувь.
11. Все растворы нужно проверять. Точные растворы — путём установки титра, приблизительные — по плотности или иным путем.
12. Растворы (за исключением точных) после приготовления следует обязательно профильтровывать. Это относится одинаково и к водным растворам, и к растворам в органических жидкостях.
13. При приготовлении растворов в органических жидкостях надо применять только чистые растворители и, когда нужно, — безводные. Если растворитель чем-либо загрязнён, его следует перегнать или очистить от примесей каким-либо другим способом.
приготовление растворов. Раствором называют однородные смеси двух или более веществ. Концентрацию раствора выражают по-разному:
|
|
|
· в весовых процентах, т. е. по количеству граммов вещества, содержащегося в 100 г раствора;
· в объемных процентах, т. е. по количеству единиц объема (мл) вещества в 100 мл раствора;
· молярностью, т. е. количеством грамм-молей вещества, находящегося в 1 л раствора (молярные растворы);
· нормальностью, т. е. количеством грамм-эквивалентов растворенного вещества в 1 л раствора.
Растворы процентной концентрации. Процентные растворы готовят как приблизительные, при этом навеску вещества отвешивают на технохимических весах, а объемы отмеривают измерительными цилиндрами.
Для приготовления процентных растворов пользуются несколькими приемами.
Пример. Необходимо приготовить 1 кг 15%-ного раствора хлористого натрия. Сколько необходимо для этого взять соли? Расчет проводится согласно пропорции:
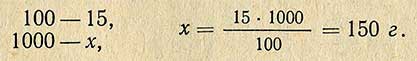
Следовательно воды для этого необходимо взять 1000-150 = 850 г.
В тех случаях, когда надо приготовить 1 л 15%-ного раствора хлористого натрия, необходимое количество соли рассчитывают другим способом. По справочнику находят плотность этого раствора и, умножив ее на заданный объем, получают массу необходимого количества раствора: 1000-1, 184 = 1184 г.
Тогда следует:
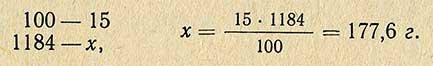
Следовательно, необходимое количество хлористого натрия различно для приготовления 1 кг и 1 л раствора. В тех случаях, когда приготовляют растворы из реактивов, содержащих в составе кристаллизационную воду, следует ее учитывать при расчете необходимого количества реактива.
Пример. Необходимо приготовить 1000 мл 5%-ного раствора Na2CO3 плотностью 1, 050 из соли, содержащей кристаллизационную воду (Na2CO3-10H2O)
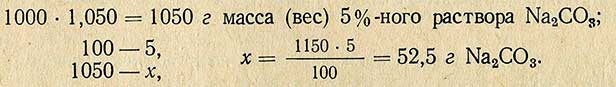
Молекулярная масса (вес) Na2CO3 равна 106 г, молекулярная масса (вес) Na2CO3-10H2O равна 286 г, отсюда рассчитывают необходимое количество Na2CO3-10H2O для приготовления 5%-ного раствора:
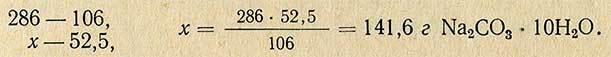
Методом разбавления растворы приготовляют следующим образом.
Пример. Необходимо приготовить 1 л 10%-ного раствора HCl из раствора кислоты относительной плотностью 1, 185 (37, 3%). Относительная плотность 10%-ного раствора 1, 047 (по справочной таблице), следовательно, масса (вес) 1 л такого раствора равна 1000X1, 047 = 1047 г. В этом количестве раствора должно содержаться чистого хлористого водорода
|
|
|
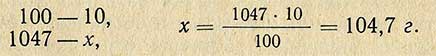
Чтобы определить, сколько необходимо взять 37, 3%-ной кислоты, составляем пропорцию:
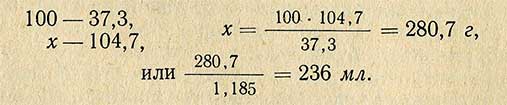
При приготовлении растворов путем разбавления или смешивания двух растворов для упрощения расчетов применяют способ диагональной схемы или «правило креста». На пересечении двух линий пишется заданная концентрация, а у обоих концов слева - концентрация исходных растворов, для растворителя она равна нулю.


|
|
|


