 |
ФП (ГФ ХII) Кислота глутаминовая
|
|
|
|
Acidum glutaminicum (ЛН) Glutamic acid (МНН)
5 4 3 *2 1
HOOC – CH2 – CH2 - CH – COOH
│
NH2
L-2-Аминопентандиовая кислота
(α- аминоглутаровая кислота)
Получение
1. Микробиологическим синтезом. Гидролиз белковых веществ и выделение АК хроматографическим методом
2. Синтетически, исходный продукт – аминослянный эфир:
Первый этап синтеза – ацетилирование (ацетиламиномалоновый эфир):
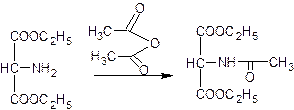
Второй – конденсация с акрилонитрилом

Третий – гидролиз

Четвертый – декарбоксилирование:

Описание
белый кристаллический порошок или бесцветные кристаллы. Легко растворим в кипящей воде, мало растворим в воде, практически не растворим в ацетоне и в спирте 96%.
Подлинность.
1. ФС ИК – спектр, снятый у субстанции ЛВ, должен соответствовать спектру стандартного образца.
2. ФС Удельное вращение [α] 5% раствора в разведенной НСI (+30 - +34)
Реакции доказательства принадлежности ЛВ к группе аминокислот.
1. ФС Нингидриновая реакция (проба). Реакции с нингидрином (трикетогидриндена гидратом) – общая фармакопейная реакция на α-АК. Реакцию дают все ЛВ α-АК, за исключением пирацетама (не вступает в реакцию) и а цетилцистеина ( вступает в реакцию только после кислотного гидролиза). Продукты реакции большинства ЛВ окрашены в сине-фиолетовый цвет. Цистеин дает красное окрашивание.
Первая стадия – разрушение глутаминовой кислоты, при этом она разлагается по общей схеме разложения под действием окислителей с выделением аммиака и диоксида углерода, а нингидрин восстанавливается в дикетоксигидринден:

дикетоксигидринден
Вторая стадия – конденсация выделившегося аммиака с нингидрином и его восстановленной формой:

сине – фиолетовое
|
|
|
окрашивание
образуется аммонийная соль енольной формы дикетогидринденкетогидринамина (синь Роймана) и может применятся для идентификации некоторых ионов металлов – меди, кальция, серебра.
Следует помнить, что реакция с нингидрином не является строго специфичной для АК, многие другие ЛВ также дают с ним окрашенные продукты: мезатон и эфедрин – сине-фиолетовый, рибофлавин – зеленый; изониазид – красный.
2. ГФ Х Реакция отличия глутаминовой кислоты от других представителей группы – сплавление глутаминовой кислоты с резорцином в присутствии конц серной кислоты. Смесь нагревают до появления зелено-коричневого окрашивания. Если теперь смесь охладить, добавить воды и раствора аммиака, то появится красно-фиолетовое окрашивание с зеленой флуоресценцией. При нагревании глутаминовая кислота переходит в пирролидонкарбоновую к-ту, которая конденсируется с резорцином:
 пиролидонкарбоновая кислота
пиролидонкарбоновая кислота

3. Реакция комплексообразования с меди сульфатом (кислотные свойства). В реакцию вступают α-аминокислоты со свободной аминогруппой, ацетилцистеин – после кислотного гидролиза. Образуется интенсивное синее окрашивание.
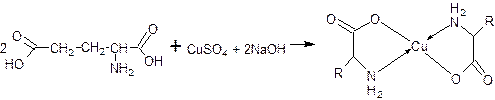
4. с растворами фенолфталеина, натрия гидроксида и формальдегида, добавляемых последовательно. Эффект реакции – появление, а при прибавлении формальдегида – исчезновение розового окрашивания.
ЛВ растворяют в воде, прибавляют раствор фенолфталеина и несколько капель раствора натрия гидроксида (0,1 моль/л). Появляется розовое окрашивание. Затем прибавляют раствор формальдегида, раствор обесцвечивается.
Так как аминокислота находится в цвиттер-ионной форме, то при добавлении раствора натрия гидроксида (0,1 моль/л) соль не образуется, а в растворе присутствует свободная щелочь, окраска в присутствии фенолфталеина- розовая. При добавлении раствора формальдегида происходит блокирование аминогруппы, т.к. образуется основание Шиффа, карбоксильная группа освобождается, кислотные свойства усиливаются и щелочь взаимодействует с аминокислотой с образованием соли. В связи с отсутствием в растворе свободной щелочи, раствор не окрашивается в розовый цвет в присутствии фенолфталеина
|
|
|
 O
O
 R – CH – COO - + H – C → R – CH – COOH + H2O
R – CH – COO - + H – C → R – CH – COOH + H2O
+│ H │
NH3 N = CH2
R – CH – COOH + NaOH → R – CH – COONa + H2O
│ │
N = CH2 N = CH2
Чистота
1. Прозрачность и цветность 10% раствора в в 1М НСI в сравнении с эталонными растворами
2. pH водного раствора (3,1-3,7).
3. Предельное содержание общих примесей - тяжелые металлы в сульфатной золе, мышьяк, хлориды.
4. Остаточные органические растворители.
5. Потеря в массе при высушивании не более 0,5%
6. Микробиологическая чистота, для нестерильных ЛС.
Специфические примеси
5. Недопустимые примеси посторонних АК определяют методом тонкослойной хроматографии. Проявляют нингидрином.
|
|
|


