 |
Что такое вторичные посредники? Перечислите вторичные посредники, приведите примеры рецепторов, передающих внутриклеточный сигнал с их помощью. Сигнальные каскады.
|
|
|
|
Вторичные посредники (вторичные мессенджеры) – компоненты системы передачи сигнала в клетке. Представляют собой низкомолекулярные химические соединения, имеющие специфическую систему синтеза и распада. В покое их мало. Концентрация ВП быстро изменяется под действием внеклеточных сигналов (гормонов, нейромедиаторов). ВП имеют четкие специфические мишени (эффекторные белки), через которые опосредуют ответ клетки.
ВП характеризуются следующими свойствами: имеют небольшую молекулярную массу и с высокой скоростью диффундируют в цитоплазме; быстро расщепляются и быстро удаляются из цитоплазмы. Вторичные посредники должны иметь высокую скорость синтеза и распада: при низкой скорости метаболизма они не буду успевать за быстрыми изменениями в стимуляции рецептора.
Выделяют 3 группы вторичных посредников.
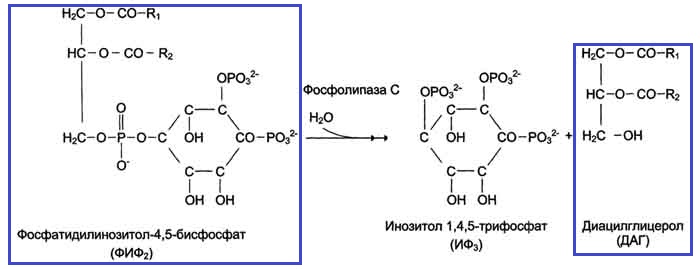
- Гидрофильные молекулы (цАМФ, цГМФ, IP3, Ca2+, Н2О2) действуют в цитозоле.

- Гидрофобные молекулы (диацилглицеролы ДАГ и фосфатидилинозитолы PIP n) действуют в мембранах локально.
 - Газы (NO, CO, H2S) являются короткоживущими, но относительно стабильными, продуктами активных форм кислорода; они растворимы в цитозоле и могут проникать в клетку извне через плазматическую мембрану.
- Газы (NO, CO, H2S) являются короткоживущими, но относительно стабильными, продуктами активных форм кислорода; они растворимы в цитозоле и могут проникать в клетку извне через плазматическую мембрану.
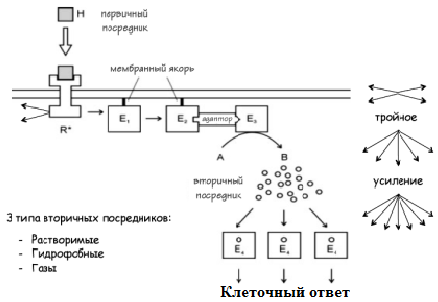
Сигнальные системы с использованием вторичных посредников имеют три уровня усиления сигнала. Первое усиление происходит на уровне мембраны. Пока Рецептор связан с лигандом, он активирует несколько мишеней (G-белков). Пока ГТФ находится в активном центре G-белка, он в свою очередь, активирует несколько эффекторов. Эти эффекторы составляют второй, и самый мощный, уровень усиления сигнала. Как правило, они являются ферментами с высокой каталитической силой и числом оборотов. В их задачу входит синтез многочисленных вторичных посредников. Это составляет третий этап усиления.
|
|
|
Вторичные посредники участвуют в передаче сигналов от мембранных рецепторов, сопряженных с G-белками.
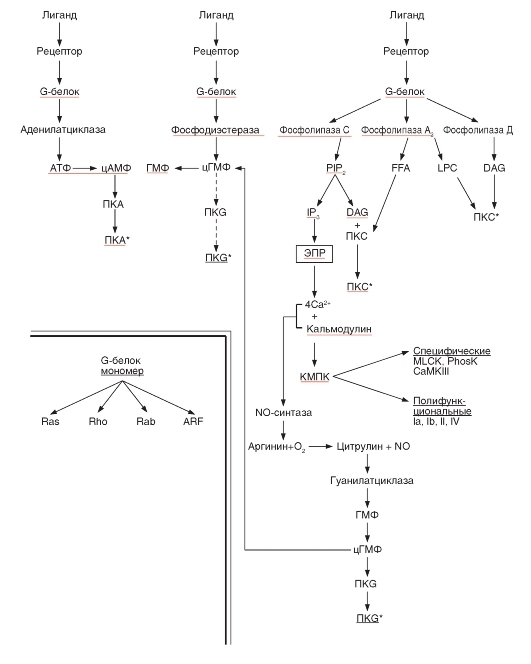
Пути сигнальной трансдукции с участием G-белков - протеинкиназ включает следующие этапы.
1) Лиганд связывается с рецептором на мембране клетки.
2) Связанный с лигандом рецептор, взаимодействуя с G-белком, активирует его, и активированный G-белок связывает ГТФ.
3) Активированный G-белок взаимодействует с одним или несколькими следующими соединениями: аденилатциклазой, фосфодиэстеразой, фосфолипазами С, А2, D, активируя или ингибируя их.
4) Внутриклеточный уровень одного или нескольких вторичных мессенджеров, таких, как цАМФ, цГМФ, Са2+, IP3 или DAG, возрастает или снижается.
5) Увеличение или уменьшение концентрации вторичного мессенджера влияет на активность одной или нескольких зависимых от него протеинкиназ, таких, как цАМФ-зависимая протеинкиназа (протеинкиназа А), цГМФ-зависимая протеинкиназа (ПКG), кальмодулинзависимая протеинкиназа (КМПК), протеинкиназа С. Изменение концентрации вторичного мессенджера может активировать тот или иной ионный канал.
6) Уровень фосфорилирования фермента или ионного канала изменяется, что влияет на активность ионного канала, обуславливая конечный ответ клетки.

(Более подробная схема):
5. Классификация мембранных рецепторов.
- по структуре и механизму действия, 4 основные группы, являющихся интегральными мембранными белками. Рецепторы, непосредственно сопряженные с ионными каналами (N-холиноРецепторы, например) (ligand-gated ion channels, LGIC) и Рецепторы, сопряженные с тримерными G-белками (М-холиноРецепторы, например)(G-protein coupled receptors, GPCR) составляют две наиболее известные и характеризованные группы. В группе рецепторов, непосредственно сопряженных с ферментами (Рецепторы инсулина, непосредственно сопряженные с тирозинкиназой, например) - несколько подгрупп: рецепторные тирозиновые киназы (receptor protein tyrosine kinases, RPTK) и небольшая группа рецепторных серин/треониновых киназ, а также Рецепторы-ферменты с некиназной активностью, такие как гуанилатциклазные (guanylyl cyclase, GCase). 4- цитокиновые Рецепторы (cytokine receptors, CR) (Рецепторы интерферонов α, β, γ, например). По способу действия они очень похожи на RРTK, но не имеют своей ферментативной активности и привлекают в качестве партнеров ферменты из цитозоля. Последними, в основном, являются протеинкиназы, которые связывают активированные цитокиновые Рецепторы и только после этого фосфорилируют специфические субстраты, таким способом передавая сигнал в цитоплазму. Следует отметить, что мембранная локализация всех этих рецепторов не означает их расположения исключительно на поверхности клетки. Они могут находиться также и на внутренних мембранах органелл, например, на эндосомах, митохондриях или эндоплазматическом ретикулуме.
|
|
|

По функциональной нагрузке: ионотропные и метаботропные. По сути, это разделение отражает тип клеточного ответа при активации этих рецепторов. Согласно названию, ионотропные Рецепторы регулируют ионные токи, т.е. управляют лиганд-зависимыми ионными каналами. Они быстро меняют мембранный потенциал и, таким образом, опосредуют наиболее быстрые реакции клеток на воздействия внешней среды (зрительные, вкусовые и обонятельные клетки). Напротив, метаботропные Рецепторы регулируют внутри клетки метаболические превращения (потоки энергии). Они используют адаптерные белки и ферменты для эстафетной передачи сигнала и изменения активности ферментов-мишеней.
6.Способы регуляции активности ферментов: изменение количества молекул белка или его посттрансляционные модификации. Типы посттрансляионных модификаций, используемых рецепторами для передачи сигнала. Примеры.
Гормоны активируют эффекторные системы рецепторов - изменение активности внутриклеточных ферментов. Под контролем гормонов 6 из 8 механизмов регуляции ферментов. 4 (ковалентная модификация, белок-белковые взаимодействия, аллостерическая регуляция и ограниченный протеолиз) - быстрые изменения удельной активности ферментов, 2 (изменение уровня экспрессии и изоформного состава белков) связаны с изменением количества ферментов в клетке и косвенно изменяют их общую активность в клетке.
|
|
|
Остально, не связ с горманами: изм-е концентраций участников р-ции, д-е метаболитов.
1) 1. Доступность субстрата или кофермента
При постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. без прямого контроля со стороны гормонов. ускорить или затормозить
Для цикла трикарбоновых кислот (ЦТК) субстратом - оксалоацетат (щавелевоуксусная кислота). Наличие оксалоацетата "подталкивает" реакции цикла, что позволяет вовлекать в окисление ацетил-SКоА.
ΔG' = ΔG0' + RT ln [(C+D)/(A+B)],
где ΔG' – реальное изменение свободной энергии Гиббса при рН 7, ΔG0' – стандартное изменение свободной энергии Гиббса при рН 7 для данной реакции (при равновесных концентрациях реактантов 1 Моль/л и 25оС), R – универсальная газовая постоянная, Т – температура по Кельвина, А,В,С,D – равновесные концентрации реактантов.
Гормоны опосредованно влияют на равновесные концентрации реактантов, действуя на необратимые реакции. Их скорость увеличивается, количество продукта тоже. Изменять активность ферментов, опосредующих равновесные реакции нет смысла, так как фермент не сдвигает равновесие реакции.
2) Во многих метаболических путях метаболиты дистанцированно влияют на активность ферментов. прямые или обратные связи внутри метаболической цепочки. Конечный метаболит - механизм обратной отрицательной связи. Начальный метаболит - прямой регуляции.
Эффекторами - конкурентные или аллостерические регуляторы.
3) Ковалентные модификации с присоединением низкомолекулярных радикалов к молекулам белка - на посттрансляционном уровне. наиболее распространенный механизм.
модификациям могут подвергаться аминокислотные остатки (остатки серина, треонина, тирозина, лизина, аргинина, пролина и дикарбоновых аминокислот). присоединяются метильные, ацетильные и гидроксильные группы, биотин, оксид азота, фосфаты, сульфаты и более крупные заместители углеводной, липидной, белковой или нуклеотидной природы (АДФ-рибозил). Гликозилирование - основной модификацией наружных белков гликокаликса, а пренилирование липидными остатками - для принудительной локализации белков на мембране.
|
|
|
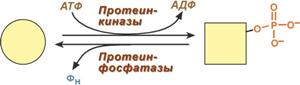 Фосфорилирование используется для передачи сигнала внутрь клетки. фосфатная группа выступает меткой, фиксирующей сам факт передачи сигнала от одного компонента каскада (протеинкиназы) к другому (субстрату). Иногда таким сигналом служит дефосфорилирование (фосфатазы)
Фосфорилирование используется для передачи сигнала внутрь клетки. фосфатная группа выступает меткой, фиксирующей сам факт передачи сигнала от одного компонента каскада (протеинкиназы) к другому (субстрату). Иногда таким сигналом служит дефосфорилирование (фосфатазы)
Фосфорилирование - изменения активности конечных участников сигнальных каскадов. Многие мишеней являются трансферазами (ковалентные модификации своих субстратов). Например, действие ряда гормонов направлено на изменения транскрипционной активности и белкового состава клетки. В нем задействованы ферменты, модифицирующие белки хроматина, транскрипционные факторы и фосфорилирующие их киназы. В результате активации киназы транскрипционных факторов и белков хроматина перемещаются из цитоплазмы в ядро, повышают доступность отдельных участков генома и активируют транскрипцию путем пост-трансляционной модификации многочисленных остатков белков-мишеней. Транскрипционные факторы (р53): фосфорилированию. ацетилированы или убиквитинированы и сумоилированы для более успешной компартментализации. Гистоны и другие белки хроматина: разнообразным модификациям - изменение плотности хроматина и повышение доступности участков ДНК для транскрипции. (фосфорилирование, метилирование и ацетилирование внутри короткой последовательности, отвечающей за функциональную активность этого белка).
4) Аллостерические ферменты - из 2 и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора к аллостерической субъединице - изменение конформацию белка и активность каталитической субъединицы.
Аллостерические ферменты (ключевыми ферментами) обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций.
фруктозо-2,6-бисфосфат, 2,3-бисфосфоглицераль- продуктами гликолиза - аллостерические регуляторы
5) Ограниченный (частичный) протеолиз проферментов - более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него пептидных фрагментов. защищает внутриклеточные структуры от повреждений. Пищеварительные ферменты (пепсин, трипсин, химотрипсин) производятся железистых клеток в неактивной форме проферментов. активируются путем ограниченного протеолиза уже в просвете желудка (пепсин) или кишечника (остальные).
|
|
|
6) белок-белковое взаимодействие – в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент.
Мембранный фермент аденилатциклаза чувствительным к воздействию G-белка, который активируется при действии на клетку некоторых гормонов (адреналина и глюкагона).
7,8) Изменение уровня экспрессии или изоформного состава ферментов - долговременными регуляторными стратегиями (транскрипционные факторы, изменяются скорость и эффективность транскрипции генов). - стероидные и тиреоидные гормоны. В комплексе с внутриклеточными рецепторами они перемещаются в ядро, где активируют или ингибируют транскрипцию в определенных участках генома.
Изменение скорости деградации белков регулируется убиквитинированием. 5-стадийный процесс с участием трех ферментов: убиквитин-активирующего, убиквитин-конъюгирующего и убиквитин-сшивающего (лигазы). регуляции этого процесса – это рецептор-зависимая активация убиквитин-лигаз. Примером такой лигазы является белок Cbl – партнер рецепторов факторов роста и цитокинов. Рецептор-зависимая активация Cbl происходит при связывании его N-концевого фосфотирозин-связывающего домена с активированным рецептором. После этого Cbl взаимодействует с акцессорными белками и запускает убиквитинирование белков-мишеней.
Индуцибельная NO-синтаза (iNOS) - быстрой смены изоформного состава белка при активации защитных реакций клетки. Две изоформы NO-синтазы – нейрональная (nNOS) и эндотелиальная (eNOS) – экспрессируются конститутивно. Экспрессия iNOS запускается при активации рецепторов провоспалительных цитокинов (интерферон, интерлейкин-1, TNFα). в условиях окислительного стресса и бактериальной инфекции изменяется суммарная активность NO-синтаз и уровень продукции вторичного посредника NO.
7. Факторы роста как основные регуляторы деления клеток. Кратко механизм их действия.
Рост и развитие клетки в нормальных и опухолевых линиях начинаются с воздействия на клетку ФР - полипептиды, которые либо секретируются клеткой, либо выделяются, когда клетка гибнет. могут циркулировать в крови, но чаще местного действия. При связывании с рецептором - повышение сродства - олигомеризация рецепторов. 1 рецептора фосфорилирует другую молекулу рецептора по тирозиновым остаткам. Белки, участвующие в передаче сигналов от рецептора, имеют домены, узнающие фосфотирозин (SH2 домены, «домен второго порядка Src киназы»). SH2-домен-содержащие белки распознают еще 10-15 аминокислот слева и справа от фосфотирозина, поэтому их связывание весьма специфично. Связавшись с рецептором, белки изменяют свою активность, могут активировать друг друга, связывать новые белки - образуются сложные олигомерные комплексы белков. ФР передают сигнал внутрь ядра с помощью МАР-киназ (митогенактивируемых протеинкиназ), которые стимулируют транскрипционные факторы - деление клеток. Регуляция происходит за счет тирозинового фосфорилирования без вторичных посредников. Заканчивается сигнал серин/треониновым фосфорилированием белков ядра.
SH3-домены узнают в белке 1 три остатка пролина, локализованные рядом. белок 2 одним доменом свяжется с рецептором ФР, а другим – с белком с 3 остатка пролина. Формирование сложного олигомерного комплекса, в составе которого проходит фосфорилирование–дефосфорилирование белков, обмен гуаниловых нуклеотидов, расщепление фосфолипидов, присоединение белков цитоскелета и т.п.
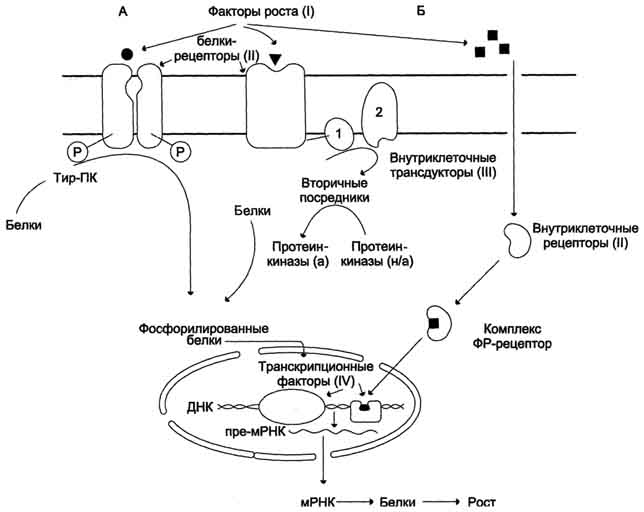 Действие ФР на клетку. ФР связываются с рецепторами либо на поверхности мембраны, либо внутри клетки. А - ФР вызывают фосфорилирование белков либо непосредственно при взаимодействии с рецептором, являющимся тир-ПК-азой (ИФР-1, ИФР-2, инсулин), либо за счёт включения аденилатциклазного или фосфатидилинозитольного каскадов и активации протеинкиназ. Фосфорилированные белки активируют транскрипционные факторы, вызывающие синтез новых мРНК и белков. Б - ФР входит в клетку, в комплексе с внутриклеточным рецептором поступает в ядро, активируя транскрипцию генов, стимулирующих рост клетки. 1 - G-белок; 2 - ферменты, синтезирующие вторичные посредники: аденилатциклаза, фосфолипаза С, гуанилатциклаза.
Действие ФР на клетку. ФР связываются с рецепторами либо на поверхности мембраны, либо внутри клетки. А - ФР вызывают фосфорилирование белков либо непосредственно при взаимодействии с рецептором, являющимся тир-ПК-азой (ИФР-1, ИФР-2, инсулин), либо за счёт включения аденилатциклазного или фосфатидилинозитольного каскадов и активации протеинкиназ. Фосфорилированные белки активируют транскрипционные факторы, вызывающие синтез новых мРНК и белков. Б - ФР входит в клетку, в комплексе с внутриклеточным рецептором поступает в ядро, активируя транскрипцию генов, стимулирующих рост клетки. 1 - G-белок; 2 - ферменты, синтезирующие вторичные посредники: аденилатциклаза, фосфолипаза С, гуанилатциклаза.
8.Каким образом связано сродство рецептора к гормону с временем развития и гашения этого сигнала? Регуляция чувствительности клеток к гормону путем изменения количества рецепторов и их сопряжения с эффекторными системами.
Max биологический эффект может развиваться даже если гормон оккупировал лишь малую долю рецепторов. (после преинкубации гладких мышц, сердца с кураре или атропином образуется прочный комплекс c антагонистом, однако эффект ацетилхолина развивается уже спустя несколько секунд после отмывания рецептора от блокатора). В клетке существует "избыток" рецепторов, благодаря чему гормон может вызывать максимальный ответ даже тогда, когда он оккупирует лишь небольшую долю рецепторов.
Концентрация катехоламинов в крови - 10-9 – 10-8 М. Сродство рецепторов к этим гормонам ниже (Кд=10-7 – 10-6 М). Полумаксимальная активация аденилатциклазы - высоких концентраций (10-7 – 10-6 М), а влияние на гликогенолиз или липолиз (эффекты, опосредуемые синтезом цАМФ) - низких концентраций (10-9 – 10-8 М).
Для проявления эффекта катехоламинам достаточно связывание менее, чем с 1% β-адренергических рецепторов. Существует 100-кратный "избыток" рецепторов гистамина, 10-кратный "избыток" рецепторов глюкагона, ангиотензина, АКТГ. Это объясняется высокой степенью усиления (105 – 108 раз) сигнала. при связывании 1 молекулы гормона в клетке может появиться (или исчезнуть) 105 – 108 молекул определенных веществ или ионов. Существование "избытка" рецепторов обеспечивает высокую чувствительность к внеклеточным регуляторам.
"оккупационная" теория: биологический эффект гормона пропорционален концентрации гормон-рецепторного комплекса: H+R ↔ HR → биологический эффект.
При достижении равновесия: Кс = [HR] / ([H][R]) или HR= Кс ([H][R]), эффект = f {Кс ([H][R])}
Эффект зависит от: сродства гормона к рецептору, концентрации рецепторов.
Уменьшение сродства рецептора к гормону, уменьшении концентраций рецепторов - более высокие концентрации гормона.
Скорость реакции определяется временем связанного состояния гормона с рецептором. У нейромедиаторов низкое сродство: около 10-3, они быстро диссоциируют от рецептора, поэтому для осуществления сигнала необходимо создавать высокие локальные концентрации, что и происходит в синапсах. У внутриклеточных рецепторов сродство к лиганду выше – около 10-9, связанное состояние продолжается часы и сутки. Сродство гормона к рецептору определяет длительность проведения сигнала.
Изменение сродства рецепторов к гормонам: десенситизации, даунрегуляцией. при избыточной гормональной стимуляции рецепторы эндоцитируют и подвергаются деградации. Образование рецепторных кластеров в мембране: Концентрирование, снижение плотности рецептора влияет на кинетические параметры связывания лиганда. (неоднородного распределения липидов в мембране, микротрубочек и микрофиламентов держат мембранные белки в определенных участках мембраны). Синапс!!
Концентрирование рецепторов, не закрепленное специальной морфологической структурой, - в лимфоцитах и асимметричных клетках слизистой. рецепторы за несколько минут собираются в кластеры в самых разных участках мембраны, распадаться - быстрый и обратимый контроль за чувствительностью клетки к регулятору.
Необратимой инактивацией рецепторных молекул: При продолжительном действии высоких концентраций регулятора - образование рецепторных "шапок", в которых рецепторов соединены между собой за счет образования пептидных связей (при участии трансглютаминазы) между свободными карбоксильными группами одного белка и свободными аминогруппами другого. После завершения сшивок - впячивание мембраны, отшнуровывание, появление в цитоплазме, сливаются с лизосомами, расщепляются протеазами. количество рецепторов может снижаться в 3-5 раз. восстановление чувствительности потребует значительного времени –синтез и встраивание.
При некоторых патологических состояниях - образовываться аутоантитела, которые, связываясь с рецепторами, изменяют их сродство к гормонам.
Сродство зависит от их взаимодействия с внутриклеточными белками-мишенями (G-белки). Хорошо известна роль G-белка при гормон-зависимой активации аденилатциклазы. G-белок не только проводит сигнал, но и влияет связывания гормона с рецептором.
Регуляции чувствительности рецепторов к гормонам: встречи рецепторов и их мишеней на мембране могут быть эффективными только если с белками связаны соответствующие кофакторы: в случае рецептора это гормон, а сопрягающего G-белка – ГТФ или ГДФ. Только в таком случае образуется функционально активный комплекс рецептора с белком, а затем белка с мишенью (аденилатциклазой). 2- связывание кофактора влияет на сродство компонентов друг к другу: Связывание лиганда повышает сродство рецептора к активным G-белком. образование рецептор-G-белкового комплекса приводит к значительному повышению сродства рецептора к гормону. После присоединения к G-белку ГТФ сродство рецептора к гормону становится низким.
9.Опишите основные этапы процессов десенситизации и даун-регуляции рецепторов.
1. Присоединение Г+Р
2. Фосфорилирование (убиквитинилирование/пальмитинирование рецептора
3. Десенситизация (бета-аррестин)
4. Эндоцитоз (клатрин-зависимый)
5. Рециклизация (выход рецептора на поверхность клетки) или слияние с лизосомой и расщепление рецептора.
Десенситизация и даун-регуляция необходимо для терминации избыточного сигнала и предотвращения чрезмерного клеточного ответа.
1) самый быстрый способ «выключения» рецептора - десенситизация обусловленная химической модификацией (фосфорилирование или реже алкилирование, пренилирование, убиквитинирование, метилирование, рибозилирование) цитоплазматического домена, приводящей к снижению сродства Р к Л.
Для гормональной регуляции, в которой участвуют Рецепторы, сопряженные с G белками, характерно быстрое развитие толерантности. Рецептор связывается с гормоном за минуты. Длится сигнал в течение минут. Чем дольше гормон находится на рецепторе, тем больше вероятность у рецептора быть фосфорилированным (более 10 минут) эндогенной протеинкиназой («лиганд-зависимая киназа»). диссоциации Г с рецептора - дефосфорилирование и Рецептор восстановит нормальную аффинность. Если же гормональный сигнал поступает в клетку в течение десятков минут, тогда включается десенситизация, в которой участвует GRK(g-prot. Receptor kinase), она дополнительно фосфорилирует рецептор, стимулируемая вторичным посредником. Если гормона много, сигнал остается и при фосфорилиловании рецептора.
Бета-аррестин- каркасный белок, он ослабляет/прекращает основной сигнальный каскад, но при этом активируется MAPKиназный или другой. На бета-аррестине также есть сайт связывания убиквитин-лигазы, которая навешивает убиквитин на рецептор. Убиквитин может способствовать разрушению белка в протеосомах или, наоборот, не дает ему идти в протеосомы (разные варианты прикрепления убиквитина). При десенситизации бета-аррестин привлекает клатрин который рекрутируется в область скопления рецепторов и покрывает внутреннюю поверхность участка мембраны, далее происходит эндоцитоз (даун-регуляция). Эти участки втягиваются, образуя окаймленные клатрином ямки. Увеличиваясь и отрываясь внутрь клетки под действием моторного белка динамина, они образуют клатрин-покрытые везикулы. Время жизни этих везикул очень мало: как только они отрываются от мембраны, клатриновая оболочка диссоциирует и распадается. (есть еще кавеолин-зависимый эндоцитоз, он происходит аналогично клатрин-зависимому, Если мембранные плоты большие и жесткие, к ним присоединяется актиновый цитоскелет, который принудительно втягивает в клетку большие фрагменты мембраны клатрин/кавеолин-независимым образом за счет работы миозиновых моторов.)
Вместе с рецепторами могут эндоцитироваться и их лиганды. В дальнейшем возможна рециклизация рецепторов (возвращение), для которой необходимы диссоциация лигандов от рецепторов и устранение химических модификаций. Необратимая деградация рецепторов при слиянии эндосом с лизосомами.
Существуют сигнальные эндосомы (сигналосом), которые способны запускать собственные сигнальные каскада, ко торые базируются на эндосомальных белках и (фосфо)липидах, в них выявляются все основные типы мембранных рецепторов за исключением канальных рецепторов.
|
|
|


