 |
Классификация по механизмам активации:
|
|
|
|
1) A-G-C-классу - ферменты, активность которых регулируется:
o циклическим АМФ - РКА,
o циклическим ГМФ – РКG,
o диацилглицеролом, фосфолипидами и ионами кальция - протеинкиназы С.
Активность ферментов регулируется вторичными посредниками.
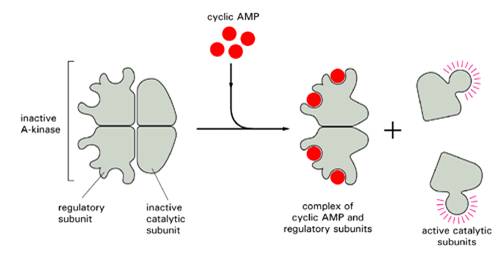 РКА: тетрамер- 2 регуляторные и 2 каталитические субъединицы. Связывание цАМФ - ингибирующие регуляторные субъединицы теряют сродство к каталитическим (могут фосфорилировать серины и треонины в своих мишенях).
РКА: тетрамер- 2 регуляторные и 2 каталитические субъединицы. Связывание цАМФ - ингибирующие регуляторные субъединицы теряют сродство к каталитическим (могут фосфорилировать серины и треонины в своих мишенях).
Участвует в регуляции метаболизма гликогена, липидов и сахаров, субстратами могут быть другие протеинкиназы или другие метаболические ферменты. За счет фосфорилирования транскрипционного фактора CREB - транскрипции генов.
РКС: + Са - переходит на мембрану, где уже был связан с мембраной DAG. + DAG - РКС прикрепляется к мембране и высвобождает из каталитического центра псевдосубстрат (псевдокиназный ингибитор), который не давал ферменту активироваться → активация РКС - фосфорилирует субстраты и опосредует внутриклеточный ответ (поддержании формы клеток, способности к движению, секреции, трансмембранном транспорте, регуляции клеточного цикла).
2) Са-кальмодулин-зависимые протеинкиназы (СаМК): 2 подкласса.
o Истинные Са-кальмодулин-зависимые протеинкиназы: активируются кальмодулином (универсальный Са-связывающий белок), связавшим Са. В случае КЛЦМ кальмодулин связан одной своей половиной с регуляторным доменом неактивной КЛЦМ. При этом кальмодулин обеспечивает аутоингибирование киназы. При связывании ионов Са2+ кальмодулин изменяет свою конформацию так, что вторая его половина также связывается с КЛЦМ. Предсуществующий комплекс КЛЦМ с кальмодулином обеспечивает быструю активацию и инактивацию фермента при повышении и снижении цитоплазматической концентрации ионов Са2+. КЛЦМ в свою очередь фосфорилирует молекулы миозина, что позволяет им образовывать поперечные мостики и связываться с актиновыми филаментами → сокращение гладких мышц.
|
|
|
o Подкласс АМФ-зависимых протеинкиназ (АМРК): Повышение концентрации АМФ свидетельствует об истощении энергетических ресурсов клетки (например, в мышцах при физической нагрузке). Активная AMPK имеет множество субстратов в клетке, в том числе она инактивирует первый комплекс mTOR (mTORC1). Это выключает анаболическую активность комплекса и запускает катаболизм с целью получения энергии.
3) C-M-G-класс – гетерогенен:
o циклинзависимые протеинкиназы (C),
o МАР-киназы (М),
o киназы гликогенсинтазы (G).
Активность регулируется внутриклеточными метаболитами (напр, полиаминами), а также путем самофосфорилирования или фосфорилирования под действием специальных протеинкиназ. В этом случае сама протеинкиназа (например, МАР-киназа) является субстратом для другой протеинкиназы, активность которой может регулироваться либо путем фосфорилирования, либо под действием какого-то вторичного посредника (цАМФ, ионы кальция, специальные фосфолипиды).
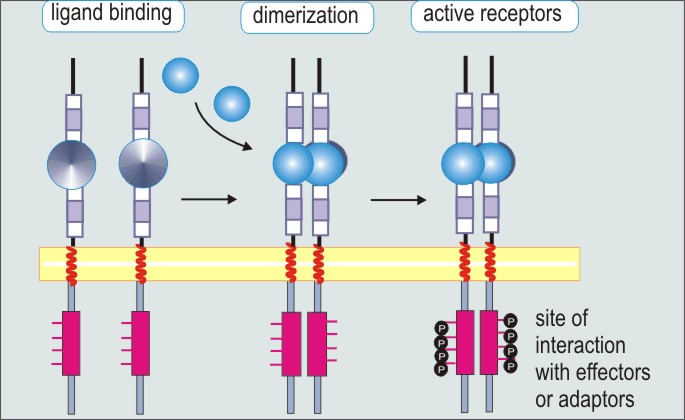
4) Tyr-киназы - димеры. мономер состоит из 3 доменов: внеклеточного (связывает специфические гормоны: инсулин, эпидермальный ФР), трансмембранного и внутриклеточного (содержит каталитический домен, способный осуществлять фосфорилирование по остаткам тирозина).
Инсулиновый Рецептор (основной).
Состоит из 2 α- и 2 β-субъединиц, которые связаны дисульфидными связями и нековалентными взаимодействиями. Связывание инсулина с α приводит к трансфосфорилированию нескольких остатков тирозина на β (т.е. одна цепь фосф-ет другую). Далее ключевым субстратом становится IRS-1 (insulin receptor substrate), который связывается с фосфотирозином через РТВ-домен, IRS-1 фосфорилируется. Далее такой IRS-1 связывается с SH2-доменом PI3-киназы, которая активируется и делает из PI-(4,5)-P2 PIP3. Последний связывается с PH-доменом протеинкиназы B, т.о. прикрепляя ее к мембране. Две мембран-связанные киназы фосф-ют РКВ, она активируется, освобождается из мембраны и активирует переносчики глюкозы GLUT, а также синтез гликогена.
|
|
|
Рецептор эпидермального ФР (EGFR). +Л - Рецептор димеризуется, самофосфорилирование по 5 остаткам тирозина на С-конце рецептора, и EGFR приобретает внутриклеточную тирозинкиназную активность. (+рецептор тромбоцитарного ФР).
5) неклассифицированные протеинкиназы. Активность регулироваться низкомолекулярных метаболитов. Часть ферментов обладает смешанной специфичностью (фосфорилировать остатки серина и треонина, и остатки тирозина (киназа МАР-киназы)).
14. Как сигнальные протеинкиназы регулируются? Их модульные домены и адаптерные взаимодействия.
Киназы подвержены строгой регуляции. 3 основных механизма:
1. самофосфорилирование или фосфорилирование другими киназами.
Самофосфорилирование характерно для тирозиновых протеинкиназ (инсулиновый R-r).
Фосфорилирование другими киназами – МАР-киназный каскад. МАР-киназы влияют на транскрипцию, причем могут это делать тремя разными способами. 1. Сами транслоцироваться в ядро и там фосфорилировать ф-ры транскрипции такие как белок с-Myc и белок Elk-1.2. МАРК может фосф-ть ф-ры транскрипции в цитоплазме, а затем последние пойдут в ядро. 3. МАРК может фосф-ть ингибитор ф-ра транскрипции, т.о. активируя фактор. Итак, повышение активности МАР-киназ происходит под действием РКС. Так как МАР-киназа при этом фосфорилируется одновременно по тирозину и серину, что не может осуществляться РКС, то между PKC и МАР-киназой существуют промежуточные звенья - киназы МАР-киназы (МАРКК) с двойной специфичностью (к тирозину и серину) и активирующие ее киназы киназы МАР-киназы (МАРККК).
2. аллостерическая регуляция за счет связывания белков-регуляторов или малых молекул (например, вторичных посредников).
Есть отдельный регуляторный домен, который позволят молекуле принять такую конформацию, что активный центр недоступен. Но когда приходит сигнал на регуляторный домен, активный центр открывается. Пример – РКА.
|
|
|
3. изменение внутриклеточной локализации.
Адаптерные белки – белки, состоящие из модулей-доменов, связывающих определенную мишень. Например, РТВ, SH2, PH-домены (см. инсулиновый рецептор). Они связывают разные белки при помощи докинг-взаимодействий.
Каркасные белки (scaffold-белки) – это частный случай адаптерных белков. Они побольше, имеют несколько адаптерных доменов и формируют определенный сигнальный каскад. Их функция – собирать или принудительно разделять участников сигнального каскада, а также локализовать каскад и определенном компартменте клетки. В разных клетках разные каркасные белки, у них разные модули, поэтому прохождение сигнала отличается.
В случае инсулинового рецептора каркасным белком является IRS. Именно он дальше распределяет сигнал, взаимодействуя с соответствующими адаптерными белками.
Еще пример – белковые комплексы, в состав которых входит протеинкиназа mTOR. Эти комплексы, сокращенно именуемые mTORC1 (mTOR комплекс 1) и mTORC2 (mTOR комплекс 2), формируются на каркасных белках Raptor или Rictor, соответственно. Первый комплекс усиливает синтез белков и липидов, когда пищевые ресурсы в достатке (анаболизм); второй регулирует направленное движение клетки (хемотаксис) по градиенту питательных веществ и поступление глюкозы в клетку под действием ростовых факторов (катаболизм).
15.Каковы функции сигнальных фосфатаз, их классификация по субстратам.
3 основных семейства фосфатаз: Фосфо-Тирозиновые фосфатазы (PTP), фосфо-Серин/Треониновые фосфатазы, и расщепляющие обе связи. Они также могут быть классифицированы по размерам, ингибиторам, требованиям к молекулярному двухвалентному катиону и т.д. В отличие от киназ, которые различаются по структуре их каталитических доменов, многие фосфатазы обеспечивают специфичность путем связывания кофакторов белков, которые облегчают перемещение и связывание с конкретными фосфобелками. Активная фосфатаза, следовательно, часто состоит из комплекса каталитической субъединицы фосфатазы и регуляторной субъединицы. Регуляторные субъединицы для тирозиновых фосфатаз может содержать домен SH2, позволяющий связывать бинарный комплекс с аутофосфорилированными тирозинкиназами мембранного рецептора.
|
|
|
Важные Ser / Thr фосфатазы включают в себя:
- Протеинфосфатаза 1 (ПП-1) - разные регуляторные субъединицы нацеливают её к частицам гликогена печени или мышечного саркоплазматического ретикулума
- Протеинфосфатаза 2A (PP-2A) - представляет собой тример с каталитическим, регуляторным и скаффолдинговым структурными субъединицами.
- Протеинфосфатаза 2B (PP-2B) - также называется кальцинейрин или Са2 + / Кальмодулин-зависимая протеинфосфатаза. Она состоит из каталитической субъединицы (кальцинейрина А) и регулирующей, связывающей кальций, субъединицей (кальцинейрин B). Она ингибируется комплексом иммунодепрессанта циклоспорина и FK506 с иммунофилинами. PP2B регулирует PKA и PKC
- Протеинфосфатаза 2C (PP-2C) - РР1, 2А и 2В имеют большую гомологию аминокислот, и на основе этой гомологии, принадлежат к одному семейству. PP2C принадлежит к другому.
Тирозиновые протеинфосфатазы (PTPs) состоят из рецептор-подобных (трансмембранных) и внутриклеточных тирозиновых фосфатаз. Они более похожи на тирозинкиназы в их строении, чем на Ser / Thr-фосфатазы. Есть около 100 PTPs, которые имеют активный сайт Cys в aCX5R-(S / T) мотиве. Важные примеры включают в себя:
- PTP1B - дефосфорилирует много рецепторов клеточной поверхности (инсулин, EGF, PDGF), которые были фосфорилированы по тирозиновым остаткам. Её основной функцией, кажется, является дефосфорилирование зарождающиеся рецепторов в эндоплазматическом ретикулуме, прежде чем они достигнут к конечному пункту назначения - клеточной мембране.
- Низкомолекулярная PTPase - они играют свою роль в обмене веществ и дифференцировке клеток. Они имеют молекулярную массу 18000 и имеют активный сайт CX5R- (S / T), мотив, где С (Cys) является нуклеофильным активным центром. Примером является кислая фосфатаза адипоцитов человека.
|
|
|


