 |
Какова роль фосфодиэстераз в регуляции гормонального сигнала? Как они регулируются?
|
|
|
|
ФДЭ – особые ферменты клетки, контролирующие уровень вторичных посредников (цАМФ и цГМФ) (глобально: от этого зависит уровень фосфорилирования/ дефосфорилирования, а значит, активности/неактивности остальных белков-участников сигнального каскада). Катализируют их гидролиз до 5'-нуклеотидмонофосфатов (АМФ и ГМФ) и различаются по сродству к цАМФ и цГМФ. Выделены и охарактеризованы растворимая кальмодулинзависимая фосфодиэстераза и мембраносвязанная изоформа, не регулируемая Са2+ и кальмодулином.
ФДЭ циклических нуклеотидов не обладают высокой специфичностью к цАМФ и цГМФ. Однако скорости гидролиза могут быть существенно разными. Есть фосфодиэстеразы более специфичные. Внутриклеточные активности зависят от соотношения концентраций этих нуклеотидов и действия регуляторов этих ферментов.
Большинство ФДЭ –растворимые ферменты. Содержание форм, связанных с внутриклеточными структурами, 5 - 40%. Константы Михаэлиса (Км) для цАМФ и цГМФ - 10-6-10-4 М. Обычно концентрация циклических нуклеотидов - 10-7-10-6 М, что существенно ниже значений Км. Если субстрат не компартментализован, то ФДЭ работают медленно, при повышении концентраций цАМФ или цГМФ гидролиз нуклеотидов заметно ускоряется.
Обратная ситуация характерна для циклаз. Константа Михаэлиса АЦ для АТФ составляет около 10-4 М, а концентрация АТФ в клетке крайне редко снижается меньше 2-3*10-3 М. Гуанилатциклаза также обычно не испытывает дефицита субстрата. При низкой "физиологической" концентрации цАМФ активности ФДЭ и неактивированной АЦ примерно равными - содержание цАМФ конст. При активации АЦ - скорость синтеза резко повышается. Повышение уровня цАМФ приводит к ускорению работы ФДЭ.
|
|
|
Активность ФДЭ: Одна из изоформ является Са2+-зависимой: она активируется связыванием Са2+-кальмодулина. Также во многих тканях цАМФ вызывает повышение концентрации Са2+ (цАМФ способствует неметаболической активации ФДЭ и возвращению уровня цАМФ к N).
Другая изоформа активируется циклическими нуклеотидами (под действием цГМФ ускоряется гидролиз цАМФ, а под действием цАМФ ускоряется гидролиз цГМФ: либо положительно кооперативным взаимодействием двух активных центров, либо существованием специальных регуляторных участков, связывание с которыми активирует фермент). При повышении уровня Са2 - возрастает активность гуанилатциклазы и цГМФ.
Регуляция активности ФДЭ: активация - поликатионы, лизоформы фосфолипидов, жирных кислот, ограниченный протеолиз.
В сетчатке глаза ФДЭ функционирует в комплексе с ГТФ-связывающим белком – трансдуцином. Трансдуцин участвует в трансдукции зрительных каналов, принадлежит к семейству as-с/ед G-белков (активирующие АЦ), он активирует ФДЭ цГМФ. При попадании кванта света на родопсин - ГДФ на ГТФ - ФДЭ активируется.
Каркасный белок mAKAP, специфичный для мышечных клеток (связывающий протеинкиназу А белок) координирует работу цАМФ-зависимого сигнального модуля, одновременно связывая PKA и ФДЭ PDE4D3. ФДЭ гидролизует цАМФ и ограничивает активацию РКА - регулируется уровень фосфорилирования белков, синхронизирующих деление клетки.
Под действием регуляторов может изменяться соотношение скоростей гидролиза цАМФ и цГМФ. Применение теофиллин, кофеин, теобромин, папаверин, НОШПА (дротаверин), трентал подавляет их гидролиз. Изменение концентрации одного может повлечь за собой изменение содержания и другого (взаимосвязь между гидролизом цАМФ и цГМФ, Са2+, регулирующие образование и распад циклических нуклеотидов). противоположное влияние на процесс- гашению регуляторного сигнала и возвращению системы в состояние покоя.
|
|
|
18. Опишите сигнальные каскады, приводящие к синтезу цГМФ. Роль гормонов и NO в регуляции гуанилатциклазы.
Гуанилатциклаза, в отличие от мембранной аденилатциклазы, может находиться и в мембране, и в растворимом состоянии. Синтезирует цГМФ из ГТФ как на мембране, так и в цитозоле. Соотношения этих двух форм фермента в различных тканях разные. Концентрация цГМФ в клетке низка (в 4—10 раз ниже концентрации цАМФ) — около 10-7 М. При активации синтеза, подавлении распада цГМФ его концентрация обычно повышается в 3—8 раз.
Рецепторы А и В предсердного натрийуретического пептида - мембранного рецептора с гуанилатциклазной активностью. ANP –полипептидный гормон, действие которого связано с образованием цГМФ, обладающего сильной вазорелаксирующей активностью. ANP секретируется мышечными клетками предсердий в ответ на повышение кровяного давления. Расширяя сосуды, он снижает концентрацию Na в крови и стимулирует диурез – отдачу воды кровью в почках. В результате объем крови падает, и давление в кровеносной системе снижается. Рецепторы ANP имеют внеклеточный домен, трансмембранный и внутриклеточный цитоплазматический домены. В свою очередь, цитоплазматическая часть состоит из домена с протеинкиназной гомологией и собственно гуанилатциклазного домена. Первый связывает АТФ и выполняет структурную функцию, второй – катализирует реакцию образования 3',5'-цГМФ по приведенной выше схеме.
3 изоформы натрийуретического пептида – NPА, NPB и NPC взаимодействуют с 3 видами ANP-рецепторов. Только ANP-Рецепторы А и В имеют гуанилатциклазный домен и участвуют в проведении гормонального сигнала. ANP-Рецептор С не имеет внутриклеточного домена, не синтезирует цГМФ, удаляет излишки ANP из кровотока.
+Л - изменениям конформации рецептора, димеризации и активации - образуется цГМФ.
Растворимая форма гуанилатциклазы состоит из 2 субъединиц, лиганд - NO, который связываясь с входящим в состав рецепторного белка гемом, активирует гуанилат-циклазную активность.
Регуляция растворимой гуанилатциклазы: окислительно-восстановительных процессов. NO-синтаза (белковый фактор, который придавал чувствительность к активирующему действию азида натрия гуанилатциклазе) способна превращать доноры азота (азид натрия, нитросоединения- нитропруссида и нитроглицерина) в NО. NO активировал гуанилатциклазу.
|
|
|

NO - вторичных посредников, синтезируется из АК аргинина NO-cинтазой. NO нестабильна – время её жизни секунды. Эффекты носят локальный характер. NO проникает через мембрану, но не имеет сигнальных рецепторов, а реализует влияния по механизмам аллостерической регуляции активности внутриклеточных ферментов-мишеней. NO - важным сигнальным посредником для сердечно-сосудистой, нервной и иммунной систем (тонус сосудистых ГМК). Высвобождение нервными окончаниями в сосудистой стенке нейромедиатора ацетилхолина - сосудистые эндотелиальные клетки синтезируют и высвобождают NO - NO диффундирует вглубь стенки сосуда и воздействует на ГМК, активируя растворимую гуанилатциклазу – цГМФ - расслабление ГМК - вазодилятацию. (нитроглицерин превращается в NO, улучшает кровоснабжение миокарда благодаря дилятации коронарных кровеносных сосудов).
Гуанилатциклаза также активируется под действием кислорода и Н2О2, жирных кислот и продукты их перекисного окисления. Многие агенты, стимулирующие окислительные процессы в мембране, приводят к резкому повышению концентрации цГМФ в клетке.
19. Кальций-зависимый сигнальный каскад передачи внутриклеточного сигнала. Что такое кальций-индуцированный выход кальция, как он осуществляется и чем регулируется?
А. Ионы Са - гидрофильные наиболее универсальные вторичные посредники, действующие в цитозоле, передающие и умножающие сигналы, получаемые от рецепторов в сигнальных системах рецепторов-каналов и рецепторов, сопряженных с G-белками (большинство 7-доменных и многие тирозинкиназные Рецепторы). Система Са сигнализации активируется путем открытия ионных каналов.
Время действия Са сигнала варьируют от микросек (запуск экзоцитоза на окончаниях нейронов) и милисек (мышечное сокращение) до мин-ч (регуляция транскрипции генов, пролиферации и миграции клеток) за счет действия нескольких различных механизмов.
|
|
|
Путь Са зависит от его концентрации, частоты колебаний концентрации, локализации, типа клеток (генерализованное повышение уровня Са/волна/локальное повышение/осцилляции концентрации).
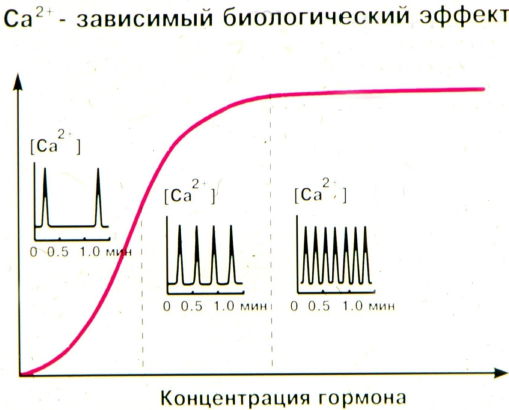 Для протекания быстрых процессов (до сек) белки-эффекторы Са должны находиться в том же компартменте. Если в сек-мин шкале времени - концентрация Са обычно поднимается во всей ЦП или протекает волна повышения-понижения уровня Са2+. Если долгая Са регуляция (транскрипция, пролиферация, миграция, оплодотворение яйцеклетки) - транзиентные повышения концентрации Са2+ регулярно повторяются - сигнал кодируется в виде частоты осцилляций.
Для протекания быстрых процессов (до сек) белки-эффекторы Са должны находиться в том же компартменте. Если в сек-мин шкале времени - концентрация Са обычно поднимается во всей ЦП или протекает волна повышения-понижения уровня Са2+. Если долгая Са регуляция (транскрипция, пролиферация, миграция, оплодотворение яйцеклетки) - транзиентные повышения концентрации Са2+ регулярно повторяются - сигнал кодируется в виде частоты осцилляций.
Б. Повышение уровня Са2+ в ЦП в некоторых типах клеток может приводить к Са2+-индуцированному выходу Са2+ из внутриклеточных депо (через IP3R и рианодиновыми рецепторами (RyR) на ЭПР) и приводит либо к генерализованному повышению уровня Са2+, либо к протеканию волны Са2+ по клетке.
Подробнее:
Гормон -> активация семидоменных и тирозинкиназных рецепторов.
Практически все 7-доменные Рецепторы могут активировать выход Са2+ в ЦП либо через Gαq/11 субъединицы, либо βγ-субъединицы.
 Gq/11 активируют различные изоформы фосфолипазы Сβ (PL-Cβ).
Gq/11 активируют различные изоформы фосфолипазы Сβ (PL-Cβ).
βγ-субъединицы отсоединяются от альфа-с/ед., диссоциируют от мембраны и либо напрямую активируют PL-Cβ, либо активируют тирозиновую киназу Btk (Bruton agammaglobulinemia tyrosine kinase), активирующую PL-Сγ, либо активируют Са каналы на плазм. мембране (ПМ) -> вход Са2+.
Тирозинкиназные Рецепторы (RPTK) также активируют фосфоинозитидный обмен, связанный с кальцием. Фосфолипаза PL-Сγ содержит SH2 домен, который связывается с фосфорилированными тирозинами на RPTK. Кроме того, фосфолипаза Сγ может активироваться при участии адаптерных белков.
 PL-С гидролизуют фосфатидил-инозитол-4,5-бисфосфат (PIP2) (минорный липид ПМ) до диацилглицерола (ДАГ) и IP3. IP3 активирует свой Рецептор на ЭПР (IP3R) и выход Са2+ из ЭР.
PL-С гидролизуют фосфатидил-инозитол-4,5-бисфосфат (PIP2) (минорный липид ПМ) до диацилглицерола (ДАГ) и IP3. IP3 активирует свой Рецептор на ЭПР (IP3R) и выход Са2+ из ЭР.
Рианодиновые Рецепторы (RyR) – это также кальциевые каналы ЭПР в мышечных клетках, регулируемые гормонально и потенциалом действия (регулируют сокращения скелетных мышц, где они физически контактируют с потенциал-открываемыми кальциевыми каналами ПМ, и сердечных мышечных клеток, где вошедший в клетку Са вызывает открытие рианодиновых рецепторов. При стимуляции адренергических рецепторов на поверхности сердечных клеток, протеинкиназа А фосфорилирует RyR, потенциируя его к нахождению в открытом состоянии).
Таким образом, IP3R и RyR открываются при повышении концентрации Са2+ в ЦП и высвобождают дополнительное количество иона.
(Суть такова, что при низких концентрациях гормона работают одни механизмы, активируя малую часть рецепторов и приводя к небольшому локальному высвобождению Са, а при превышении уровеня Са2+, включается Са2+-индуцированный выход Са2+ (усиление клеточного ответа) и происходит генерализованный ответ Са2+ - другой клеточный ответ).
|
|
|
А.2 При превышении пороговой концентрации Са2+ активизируется системы вывода из ЦП: саркоэндоплазматическая Са2+-АТФаза (SERCA), Са2+-АТФаза плазматической мембраны (PMCA), катионные обменники плазм мембраны и митохондрий (натрий-кальциевый обменник (NCX)) и митохондриальный Са унипортер.
PMCA и SERCA при высоком сродстве к Са работают медленно (поддерживают низкий уровень Са2+ в покоящихся клетках, что позволяет реализовываться сигнальным функциям Са, SERCA наполняет ЭПР, подготавливая к проведению нового сигнала.). NCX и митохондриальный унипортер быстрее работают, но с меньшим сродством ("выключение" передачи Са сигнала в широких пределах).
20. Кальций-зависимый сигнальный каскад передачи внутриклеточного сигнала. Роль кальций-связывающих белков в реализации эффектов рецепторов, сопряженных с фосфоинозитидным обменом. (См. РЦ 19 и 21)
А. Кальций-связывающие белки опосредуют многообразие физиологических ответов. Состав буферов и их локализация играет значительную роль в том, какие характеристики будет иметь кальциевый сигнал в конкретной клетке. Са-буферы регулируют пространственно-временные характеристики Са сигнального ответа клетки, влияя на амплитуду сигнала, на время вывода кальция из цитоплазмы, поддерживают постоянный уровень Са2+ в ЦП и ЭПР в покоящихся клетках.
Большая часть Са в ЦП быстро связывается с буферами (препятствуя распространению сигнала), лишь малая часть достигает эффекторов. Буферы разные: одни- кальбиндин и кальретинин быстро связывают и отдают кальций, в то время как другие - парвальбумин имеет высокое сродство к кальцию и очень медленно отдает катион.
В цитоплазме при передаче внутриклеточного сигнала Са2+ связывается с белками, содержащими EF-hand домен (кальмодулин, тропонин С, цитоскелетный белок α-актинин, фосфолипаза С), либо С2-домен (протеинкиназа С - PKC).
 Б. Фосфоинозитидный обмен, связанный с Са, активируют 7-доменные и тирозинкиназные Рецепторы (RPTK). Из фосфолипида, локализованного во внутреннем листке плазматической мембраны фосфатидилинозитол 4,5-биcфосфата (PIP2) = Трифосфоинозитид (ТФИ) под действием фермента фосфолипацы С, образуются два вторичных посредника: диацилглицерол (ДАГ) и инозитол 1,4,5-трисфосфат (IP3). Существует две формы фосфолипазы С: PLC-β и PLC-γ. PLC-β активируется G-белком. PLC-γ активируется рецепторными тирозиновыми киназами. ДАГ активирует протеинкиназу С, а IP3 вызывает повышение внутриклеточной концентрации Ca2+. ДАГ остается в связанном с мембраной состоянии, а IP3 высвобождается в цитоплазму, где высвобождает Ca2+ из внутриклеточных депо. Концентрация Ca2+ может повышаться не только благодаря их выходу из внутриклеточных депо, но и за счет входа из внеклеточного пространства. Повышение концентрации Ca2+ приводит к активации ряда Ca2+-зависимых протеинкиназ и фосфатаз.
Б. Фосфоинозитидный обмен, связанный с Са, активируют 7-доменные и тирозинкиназные Рецепторы (RPTK). Из фосфолипида, локализованного во внутреннем листке плазматической мембраны фосфатидилинозитол 4,5-биcфосфата (PIP2) = Трифосфоинозитид (ТФИ) под действием фермента фосфолипацы С, образуются два вторичных посредника: диацилглицерол (ДАГ) и инозитол 1,4,5-трисфосфат (IP3). Существует две формы фосфолипазы С: PLC-β и PLC-γ. PLC-β активируется G-белком. PLC-γ активируется рецепторными тирозиновыми киназами. ДАГ активирует протеинкиназу С, а IP3 вызывает повышение внутриклеточной концентрации Ca2+. ДАГ остается в связанном с мембраной состоянии, а IP3 высвобождается в цитоплазму, где высвобождает Ca2+ из внутриклеточных депо. Концентрация Ca2+ может повышаться не только благодаря их выходу из внутриклеточных депо, но и за счет входа из внеклеточного пространства. Повышение концентрации Ca2+ приводит к активации ряда Ca2+-зависимых протеинкиназ и фосфатаз.
Кальмодулин – важный сигнальный белок. При повышении внутриклеточной концентрации Ca2+, кальмодулин, связываясь с ионами Ca2+, измененяет свою конформацию и активируется. Активированный кальмодулин связывается с рядом цитоплазматических белков-мишеней и, регулируя их активность, участвует в передаче сигнала.
EF-рука - Са2+ связывающий домен спираль-петля-спираль. При активации кальцием, кальмодулин связывается с белками, неспособными самостоятельно связывать Са2+. К кальмодулин-зависимым белкам относятся Са2+/кальмодулин-зависимая протеинкиназа, киназа легких цепей миозина, изоформы аденилат-циклаз и фосфодиэстераз, киназа фосфорилазы гликогена, NO-синтаза и др.
 Са2+-кальмодулин-зависимые протеинкиназы (СаМК) активируются связавшим Са2+ /кальмодулином.
Са2+-кальмодулин-зависимые протеинкиназы (СаМК) активируются связавшим Са2+ /кальмодулином.
В случае киназы легких цепей миозина (КЛЦМ) кальмодулин связан одной половиной с регуляторным доменом неактивной КЛЦМ. Са2+-кальмодулин вызывает диссоциацию автоингибиторной последовательности от активного центра КЛЦМ, делая возможным связывание легких цепей миозина.
Предсуществующий комплекс КЛЦМ с кальмодулином обеспечивает быструю активацию и инактивацию фермента при повышении и снижении концентрации Са2+. КЛЦМ фосфорилирует остаток Ser-19 в регуляторных легких цепях миозина, что позволяет актину взаимодействовать с миозином, активировать его АТФ-азу и инициировать сокращение.
*Са2+/кальмодулин-зависимая протеинкиназа II (CaMKII). Для ее активации требуются Са и кальмодулин. Киназа может аутофосфорилироваться, повышая и продлевая киназную активность даже в отстутствие активирующих агентов. Для этого с СаМКII должны связаться 2 кальмодулина, каждый из которых содержит 4 Са. Низкочастотные всплески кальция большой длительности намного более эффективны в активации СаМКII, чем высокочастотные осцилляции. СаМКII конвертирует частоту и длительность кальциевых колебаний в разные уровни ферментативной активности.
**Как ДАГ активирует протеинкиназу С? РКС – это большая группа серин-треониновых протеинкиназ. Псевдосубстратный домен ингибирует ее активность в отсутствие рецепторного сигнала, домен С1 - связывает ДАГ и форболовые эфиры, домен С2 - связывает Са.
Протеинкиназа С в норме - цитоплазматический белок. Связываясь с С2 доменом, Са2+ вызывает транслокацию РКС на плазм мембрану (С2 домен+Са связывает мембранные фосфолипиды фосфатидилсерин и PIP2). На мембране С1 домен связывается с ДАГ, он закрепляет протеинкиназу там и активирует киназу. При снижении цитоплазматического уровня кальция PKС уходит с мембраны и теряет активность.
 Некоторые изоформы РКС (дельта) не связывают Са2+, поэтому перемещаются к мембране по другим механизмам (связываются с фосфотирозинами).
Некоторые изоформы РКС (дельта) не связывают Са2+, поэтому перемещаются к мембране по другим механизмам (связываются с фосфотирозинами).
В результате действия липаз из ДАГ высвобождается арахидоновая кислота (субстрат липоксигеназного и циклооксигеназного путей синтеза лейкотриенов, простагландинов и тромбоксанов).
21. Опишите фосфоинозитид-зависимую сигнальную систему.



22.Через какие каналы кальций входит в цитоплазму из внеклеточной среды? Опишите группы каналов и их регуляцию.
 1. Потенциал-открываемые кальциевые каналы (voltage operated Са2+ channels – VOCC) выявляются, в основном, в возбудимых клетках. Они открывают мощный ток кальция в цитоплазму в ответ на деполяризацию мембраны и контролируют быстрые клеточные процессы, такие как мышечное сокращение и экзоцитоз везикул на пресинаптических окончаниях нейронов. Их чувствительность регулируется аденилатциклазной сигнальной системой.
1. Потенциал-открываемые кальциевые каналы (voltage operated Са2+ channels – VOCC) выявляются, в основном, в возбудимых клетках. Они открывают мощный ток кальция в цитоплазму в ответ на деполяризацию мембраны и контролируют быстрые клеточные процессы, такие как мышечное сокращение и экзоцитоз везикул на пресинаптических окончаниях нейронов. Их чувствительность регулируется аденилатциклазной сигнальной системой.
 2.Рецептор-открываемых кальциевых каналов (receptor operated Са2+ channels – ROCC). Входит в группу LOCC (лиганд-открываемые кальциевые каналы)Целая группа кальциевых каналов открывается в результате действия внеклеточных первичных посредников. Например, NMDA (N-methyl-D-aspartate) Рецепторы являются кальциевыми каналами, открываемыми в ответ на действие глутамата, или адениновыми нуклеотидами(Р2-пуриноРецепторы).
2.Рецептор-открываемых кальциевых каналов (receptor operated Са2+ channels – ROCC). Входит в группу LOCC (лиганд-открываемые кальциевые каналы)Целая группа кальциевых каналов открывается в результате действия внеклеточных первичных посредников. Например, NMDA (N-methyl-D-aspartate) Рецепторы являются кальциевыми каналами, открываемыми в ответ на действие глутамата, или адениновыми нуклеотидами(Р2-пуриноРецепторы).
Условиями открытия канала являются связывание глутамата с рецептором и деполяризация мембраны, приводящая к удалению Mg2+, который является блокатором канала. Это достигается совместным действием двух агонистов - нейротрансмиттеров, один деполяризует клетку и готовит ее к взаимодействию с глутаматом.Glu может делать и то и другое сам, активируя вначале АМРА Рецепторы, обеспечивающие деполяризацию постсинаптической клетки.
3.(SMOC - second messenger operated Са2+ channels) открывается в результате действия вторичных посредников. В качестве могут выступать инозитол-1,4,5-трисфосфат,инозитол-1,3,4,5-тетракисфосфат,ионы Са2+ и циклические нуклеотиды (cGMP и cAMP). Данные о влиянии продуктов фосфоинозитидного метаболизма на ионную проницаемость плазматической мембраны очень фрагментарны. Из активируемых вторичными посредниками проводящих Са2+ каналов лучше всего исследованы cGMP/cAMPчувствительные каналы. Они представляют собой низкоселективные катионные каналы, активируемые циклическими нуклеотидами с внутренней стороны мембраны. Впервые эти каналы были обнаружены в палочках сетчатки (Fesenko et al., 1985), а затем их существование было показано в колбочках сетчатки (Nakamura & Gold, 1987). В фоторецепторных клетках эти каналы активируются под действием cGMP. Они открываются при непосредственном связывании с ними циклических нуклеотидов - cGMP (фотоРецепторы) и cAMP/cGMP (обонятельные нейроны), без участия протеинкиназ.
|
|
|


