 |
Всасывание аминокислот
|
|
|
|
Механизм всасывания аминокислот и низкомолекулярных пептидов – сложный биологический процесс, который включает взаимодействие аминокислот и пептидов с мембранами клеток, формирующих ворсинки слизистой оболочки, их транслокацию через мембраны и высвобождение в кровь. Считается, что этот процесс обеспечивается специфическими переносчиками. Трансмембранная транслокация аминокислот происходит преимущественно против градиента их концентрации и является энергозависимым процессом. В процессе всасывания важная роль принадлежит натриевому насосу.
Одним из механизмов транспорта аминокислот является g-глутамильный цикл. Ключевой фермент процесса - g-глутамилтрансфераза. Этот фермент катализирует перенос глутамильного остатка глутатиона на транспортируемую кислоту:
аминокислота + глутатион (глутамилцистеинилглицин) ¾ ¾ ® глутамиламинокислота + цистеинилглицин
Свободная аминокислота, участвующая в этой реакции, поступает с наружной поверхности клетки, глутатион находится внутри. После реакции глутамиламинокислота оказывается в клетке вместе с цистеинилглицином. Далее эта кислота расщепляется ферментом цитозоля глутамиламинотрансферазой: глутамиламинокислота ¾ ® аминокислота + 5-оксопролин.
В итоге молекула аминокислоты оказывается в цитозоле.
Благодаря высокой проницаемости слизистой кишечника новорожденных и низкой концентрации у них протеолитических ферментов может всасываться некоторое количество нативных белков, обуславливающих сенсибилизацию организма.
Всасываемые в тонком отделе кишечника аминокислоты попадают в портальный кровоток и, следовательно, в печень, а затем в общий кровоток. Кровь освобождается от аминокислот очень быстро – уже через 5 минут 85 – 100 % их оказывается в тканях. Особенно интенсивно поглощают аминокислоты печень и почки.
|
|
|
· пути использования аминокислот в организме животных
Использование аминокислот в организме животных осуществляется по следующим направлениям (рис. 16):
1) для синтеза белков и пептидов;
2) для образования других аминокислот и азотсодержащих соединений;
3) для синтеза углеводов (глюкогенные аминокислоты) и липидов (кетогенные аминокислоты);
4) как источник энергии.
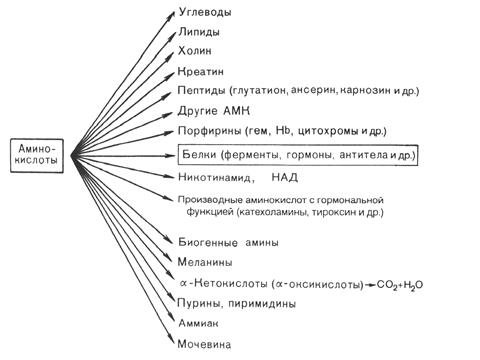
Рис. 16. Пути использования аминокислот в тканях организма животных.
Во 2-м и 3-м случаях аминокислоты теряют аминогруппу, а их безазотистый углеродный скелет превращается в один из следующих промежуточных продуктов метаболизма – пируват, оксалоацетат, a-кетоглутарат, сукцинил-КоА, фумарат, ацетил-КоА, ацетоацетил-КоА (для каждой аминокислоты свой промежуточный продукт).
Те аминокислоты, безазотистые остатки которых превращаются в один из первых пяти веществ называются глюкогенными, потому что эти соединения через фосфоенолпируват далее вовлекаются в глюконеогенез (рис. 17). К глюкогенным аминокислотам относятся глицин, серин, a-аланин, цистеин, валин, метионин, треонин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, аргинин, пролин, гистидин.
К кетогенным относятся аминокислоты, безазотистые углеродные остатки которых превращаются в ацетил-КоА или ацетоацетил-КоА, которые далее включаются в кетогенез.
Кетогенной аминокислотой является лейцин.

Рис. 17. Сема включения аминокислот в ЦТК и в глюконеогенез.
Изолейцин, лизин, триптофан, фенилаланин и тирозин относятся одновременно и к кетогенным и к глюкогенным аминокислотам. Некоторые из их углеродных атомов обнаруживаются в ацетил-КоА или ацетоацетил-КоА, тогда как другие появляются в потенциальных предшественниках глюкозы.
|
|
|
Избыток аминокислот относительно того их количества, которое требуется для синтеза белков и других биомолекул, в отличие от глюкозы и жирных кислот не может запасаться и не выделяется из организма. Избыточные аминокислоты используются как метаболическое топливо (конечные продукты распада аминокислот – NH3, выделяющийся из организма в виде мочевины, СО2, Н2О и АТФ).
· катаболизм аминокислот
Дезаминирование аминокислот является одним из наиболее общих процессов обмена аминокислот. Существует несколько типов дезаминирования аминокислот. При восстановительном дезаминировании образуются аммиак и предельные карбоновые кислоты. При гидролитическом – аммиак и гидроксикислоты. Эти два вида дезаминирования характерны для большинства бактерий, населяющих преджелудки жвачных и толстый отдел кишечника других видов животных. При внутримолекулярном дезаминировании образуются непредельные кислоты и аммиак. В организме животных таким путем дезаминируется аминокислота гистидин. Наиболее распространенным видом дезаминирования является окислительное, при котором образуются аммиак и кетокислоты. В реакциях окислительного дезаминирования принимают участие ферменты оксидазы и дегидрогеназы аминокислот.
Оксидазы L-аминокислот в качестве кофермента содержат ФМН, а оксидазы D-аминокислот – ФАД. Однако активность оксидаз аминокислот в физиологических условиях невелика.
Важная роль в процессе окислительного дезаминирования принадлежит глутаматдегидрогеназе (ГлДГ). Она участвует в окислительном дезаминировании глутаминовой кислоты, в результате чего образуются аммиак и a-кетоглутаровая кислота.
СООН СООН СООН
½ ½ ½
(СН2)2 НАД (CH2)2 Н2О (CH2)2
½ ¾ ¾ ¾ ¾ ¾ ¾ ® ½ ¾ ¾ ¾ ® ½
CHNH2 НАДН(Н+) С=NH NH3 C = O
|
|
|
½ ½ ½
COOH СООН COOH
глутаминовая иминоглутаровая a-кетоглутаровая
кислота кислота кислота
ГлДГ присутствует только в митохондриальном матриксе и ответственна за большую часть аммиака, образующегося в тканях животных.
Окислительное дезаминирование аминокислот осуществляется в организме животных непрямым путем, так как оно сопряжено с процессом трансаминирования.
Реакции трансаминирования, в ходе которых осуществляется перенос аминогруппы с аминокислоты на кетокислоту, катализируются ферментами аминотрансферазами, содержащими в качестве кофермента пиридоксальфосфат (ПФ).
Аминотрансферазы широко распространены во многих органах и тканях (печень, сердце, почки, мышцы и др. )
Наибольшее значение имеют аланинаминотрансфераза (АлТ) и аспартатаминотрансфераза (АсТ).
СООН СООН СООН СООН
½ ½ ½ ½
(СН2)2 СНNH2 ПФ (CH2)2 C = O
½ + ½ ¾ ¾ ¾ ¾ ® ½ ½
C = O CH3 АлТ СHNH2 CH3
½ ½
COOH COOH
a-кетоглутаровая a-аланин глутаминовая пировиноградная
|
|
|
кислота кислота кислота
СООН СООН СООН СООН
½ ½ ½ ½
СН2 СНNH2 ПФ CH2 C = O
½ + ½ ¾ ¾ ¾ ¾ ® ½ ½
C = O CH3 АсТ СHNH2 CH3
½ ½
COOH COOH
щавелевоуксусная a-аланин аспарагиновая пировиноградная
кислота кислота кислота
Определение активности АсТ и АлТ широко используется в лабораторной практике для диагностики патологий печени.
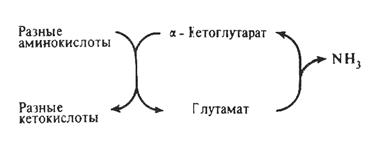
Рис. 18. Связь процессов трансаминирования и дезаминирования
через a-кетоглутаровую и глутаминовую кислоты.
Глутаминовая кислота, образованная в реакциях трансаминирования, далее подвергается окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего образуется a-кетоглутаровая кислота, которая может пополнять фонд ЦТК и служить субстратом для реакций трансаминирования.
Таким образом, в результате последовательных реакций, катализируемых аминотрансферазами и глутаматдегидрогеназой, происходит дезаминирование исходной аминокислоты. Однако оно происходит не прямым путем (рис. 18), а через реакцию трансаминирования с участием a-кетоглутаровой или щавелевоуксусной кислот, являющихся акцепторами аминогруппы (непрямое дезаминирование).
Кроме того, трансаминирование является одним из путей синтеза заменимых аминокислот в организме животных.
Одним из путей обмена аминокислот является их декарбоксилирование, сопровождающееся образованием СО2 и биогенных аминов.
Декарбоксилазы аминокислот в качестве кофермента содержат пиридоксальфосфат.

Амины, образующиеся при декарбоксилировании соответствующих аминокислот, выполняют в организме определенную биологическую роль, влияют на процессы обмена веществ и функции определенных органов и тканей.
|
|
|
Так, при декарбоксилировании гистидина образуется гистамин, расширяющий капилляры и снижающий кровяное давление. Он также усиливает секрецию соляной кислоты в желудке.
При декарбоксилировании глутаминовой кислоты образуется g-аминомасляная кислота (ГАМК), которая тормозит деятельность нервных клеток.
· токсичность аммиака и пути его нейтрализации
В процессе дезаминирования аминокислот, аминов и некоторых других азотсодержащих соединений образуется аммиак, который является высокоактивным, а отсюда и токсичным для организма, особенно для мозга. Поэтому концентрация его в организме поддерживается на низком уровне (в норме уровень аммиака в крови не превышает 1 – 2 мг/л). Концентрация 50 мг/л является токсичной. Высокую токсичность аммиака можно объяснить его свойствами. Он может легко проникать через мембраны, в т. ч. митохондриальные. В результате он может локально изменять рН в отдельных структурах клетки, значение заряда на мембранах, а также взаимодействовать с a-кетоглутаровой кислотой, смещая равновесие глутаматдегидрогеназной реакции в сторону образования глутаминовой кислоты.
СООН СООН
½ ½
СН2 НАДН(Н+), NH3 СН2
½ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ® ½
СН2 глутаматдегидрогеназа СН2
½ ½
С = О НАД+, Н2О СНNH2
½ ½
СООН СООН
a-кетоглутаровая глутаминовая
кислота кислота
a-кетоглутаровая кислота выходит из ЦТК, а НАДН(Н+) не поступает в дахательную цепь, что приводит к нарушению синтеза АТФ. Органы и ткани (в первую очередь головной мозг) испытывают энергетический голод.
Несмотря на постоянное образование аммиака в организме, концентрация его незначительная. Это объясняется механизмами своевременного обезвреживания аммиака.
В организме животных существуют следующие пути нейтрализации аммиака – синтез аммонийных солей, образование амидов моноаминодикарбоновых аминокислот и синтез мочевины.
Синтез аммонийных солей происходит в почках и занимает небольшой удельный вес в процессе детоксикации аммиака (на долю азота аммонийных солей приходится до 6 % азота мочи).
Обезвреживание аммиака на месте его образования (печень, мозг, почки, мышцы и др. ) происходит за счет амидирования аспарагиновой и глутаминовой кислот с образованием соответственно аспарагина и глутамина.
O O
// //
С – ОН C - NH2
½ ½
CH2 АТФ CH2
½ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ® ½
CHNH2 аспарагинсинтетаза СНNH2
½ ½
CОOH АМФ, Н4Р2О7 CОOH
аспарагиновая кислота аспарагин
O O
// //
С – ОН C - NH2
½ ½
СН2 АТФ СН2
½ ½
СН2 ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ® СН2
½ ½
СНNH2 глутаминсинтетаза CHNH2
½ ½
СООН АДФ, Н3РО4 СООН
глутаминовая кислота глутамин
Аспарагин и глутамин поступают в печень. Где снова превращаются соответственно в аспарагиновую и глутаминовую кислоты с высвобождением аммиака, который используется для биосинтеза мочевины. Животные, у которых конечным продуктом катаболизма белков является мочевина, называются уреотелическими.
|
|
|


