 |
7.5. Подведение итогов занятия.
|
|
|
|
7. 5. Подведение итогов занятия.
7. 6. Задание на дом. Реакции комплексообразования
Место проведения самоподготовки: читальный зал и др.
Литература [1], [3].
Занятие №5
Тема. Реакции комплексообразования.
1. Актуальность темы. Практически все ионы d-элементов в условиях организма находятся в связанном состоянии, т. к. образуют комплексные соединения с различными биолигандами, в состав которых входят донорные атомы кислорода, азота, серы. Биокомплексные соединения значительно различаются по своей устойчивости. Одни из них настолько прочны, что постоянно находятся в организме и выполняют определенную функцию. Роль металла в таких комплексах высокоспецифична; замена его даже на близкий по физико-химическим параметрам металл приводит к значительной или полной утрате физиологической активности. Примерами таких соединений является гемоглобин (только кобальтовый аналог этого соединения обладает незначительной способностью связывать и переносить кислород); витамин В-12, хлорофилл. С другой стороны, в организме есть весьма непрочные комплексные соединения, которые часто образуются только на то время, которое нужно для выполнения определенных функций (например, образование между ионом металла - активатором и ферментом комплексного соединения на период осуществления катализа). Специфичность металла таких комплексов часто не ярко выражена, он может быть заменен на другой без потери физиологической активности.
К биокомплексам с невысокими значениями констант устойчивости можно отнести и такие, которые стабилизируют сложные структуры. Например, образование металлополинуклеотидных комплексов стабилизирует двойную спираль ДНК.
|
|
|
В живых организмах найдено много ферментов, в состав которых входят ионы металлов. Для организма характерно не только протолитический и ионный гомеостаз, но также поддержание на постоянном уровне и концентрации веществ лигандообменных равновесий. Нарушение металлолигандного гомеостаза приводит к различным патологиям. В таких случаях организм включает защитные механизмы и со временем возвращает основные показатели к норме. Однако в ряде случаев возникает необходимость в проведении фармакотерапии.
2. Учебные цели: сформировать системные знания по теории равновесий в реакциях комплексообразования для обоснования протекающих в условиях живых организмов образования и разрушения биокомплексных соединений и поддержания металлолигандного гомеостаза.
Для формирования профессиональных компетенций обучающийся должен знать:
· понятия молекула, ионы, простые и сложные соединения;
· типы реакций присоединения, внедрения, диссоциации;
· типы гибридизации атомных орбиталей.
уметь:
· писать и уравнять химические реакции;
· проводить расчеты по формулам и уравнениям;
· предвидеть возможность протекания реакций в ту или другую сторону.
владеть:
· методами самостоятельной работы со справочной литературой;
· техникой безопасности при работе с растворами кислот, щелочей и стеклянной посудой;
· навыками решения расчетных задач.
3. Материалы для самоподготовки к усвоению данной темы.
Вопросы для самоподготовки
1. В чем различие простых и комплексных соединений?
2. В чем сущность координационной теории А. Вернера?
3. Классификация комплексных соединений: а) по заряду комплексного иона, б) по природе лиганда.
4. Внутрикомплексные соединения (хелаты).
5. Константы устойчивости и нестойкости комплексных соединений. Связь между ними.
|
|
|
6. Лигандообменные процессы в жизнедеятельности и их значение.
7. Понятие о металло-лигандном гомеостазе.
8. Понятие о хелатотерапии и ее применение.
9. Приведите примеры биокомплексных соединений, содержащих железо, кобальт, цинк.
10. Напишите формулы следующих комплексных соединений: гексанитрокобальтат (III) натрия; хлорид гексаамминникеля (II); дибромодихлороаурат (III) кальция; сульфат бромопентааминкобальта (III); хлорид дихлородиамминплатины (IV).
4. Вид занятия: лабораторное занятие.
5. Продолжительность занятия: 3 академических часа.
6. Оснащение рабочего места:
6. 1. Дидактический материал: справочник физико-химических величин,
6. 2. ТСО: калькуляторы.
6. 3. Посуда и приборы: пробирки, штатив для пробирок- на группу.
6. 4. Объекты исследования: 0, 1М растворы Bi(NO3)3, CuSO4, FeCl3, K4[Fe(CN)6], K3[Fe(CN)6], 0, 1% AgNO3 (на группу).
6. 5. Реактивы: 10%NH3, 0, 1Mрастворы HNO3, KCNS, KI, NaCl, KMnO4, H2SO4, NaOH, H2C2O4, cухой FeSO4, металлический Zn(на группу).
7. Содержание занятия.
7. 1. Образец билета входного контроля.
1. Названию трифторогидроксобериллат магния соответствует формула комплексного соединения:
А) Mg(OH)2× BeF2 Б) Mg[BeF3(OH)] В) Be[MgF3(OH)]
Г) Mg[BeF2(OH)2] Д) Be[Mg(OH)2F2]
2. Заряд комплексообразователя в комплексном соединении Ba[Pt(NO3)2Cl2] равен:
А) +2 Б) -1 В)+4 Г) 0 Д) -4
3. Тип гибридизации центрального иона в комплексе Na[AlF4]:
А) sp Б) sp2 В) sp3 Г) d1sp3 Д) d2sp3
4. Данные лиганды являются бидентантными:
А) Cl- Б) S2O 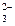 В) NH2CH2COOH Г) CN- Д) NH3
В) NH2CH2COOH Г) CN- Д) NH3
5. В комплексных соединениях [Co(NH3)6][Cr(CN)6] и [Co(CN)6][Cr(NH3)6] имеется вид изомерии:
А) гидратная Б) ионизационная В) координационная
Г) геометрическая Д) межрядовая
6. В левой колонке приведены комплексные ионы, в правой их константы нестойкости. Укажите самый прочный и наименее прочный комплексы:
А) [HgCl4]2- 1) 8, 5× 10-16
|
|
|
Б) [HgBr4]2- 2) 1, 0× 10-21
В) [Cd(CN)4]2- 3) 7, 8× 10-18
Г) [Cu(NH3)4]2+ 4) 1, 0× 10-12
Д) [PtCl4]2- 5) 1, 0× 10-16
|
|
|


