 |
3.Материалы для самоподготовки к усвоению данной темы.
|
|
|
|
3. Материалы для самоподготовки к усвоению данной темы.
Вопросы для самоподготовки.
1. Дайте определение буферных растворов и их классификацию.
2. Как можно приготовить буферные растворы?
3. В чем механизм буферного действия? Покажите это на примерах ацетатного и фосфатного буферов.
4. Как рассчитывают рН буферных растворов различных типов по уравнениям Гендерсона-Гассельбаха?
5. От каких факторов зависит рН буферных растворов?
6. Что такое зона буферного действия? Как ее оценивают?
7. Что такое буферная емкость? Как ее рассчитывают по кислоте и по щелочи?
8. От чего зависит буферная емкость?
9. Какие буферные системы содержатся в организме человека? Какая из них обладает наибольшей буферной емкостью?
10. Какие механизмы обеспечивают постоянство рН биосред организма?
4. Вид занятия: лабораторное занятие.
5. Продолжительность занятия: 3 академических часа.
6. Оснащение рабочего места:
6. 1. Дидактический материал: справочник физико-химических величин,
6. 2. ТСО: калькуляторы.
6. 3. Посуда и приборы: штатив с пробирками, бюретка, 2 конические колбы, пипетки, 2 мерные пробирки на группу.
6. 4. Объекты исследования: 0, 1 М растворы CH3COOH и CH3COONa (на группу).
6. 5. Реактивы: 0, 1 М растворы HCl, NaOH; индикаторы метиловый оранжевый или метиловый красный(на группу).
7. Содержание занятия:
7. 1. Образец билета входного контроля.
1. Буферными системами являются смеси:
А) NaOHиH2SO4 Б) CH3COONaиNaOH
В) HCOOHиHCOONa Г) NaClиHCl
Д) NaH2PO4иK2HPO4
2. рН аммонийного буфера рассчитывают по формуле:
|
|
|
А)  Б)
Б) 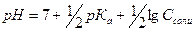
В)  Г)
Г) 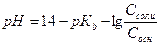
Д) 
3. Фосфатный буфер способен поддерживать рН в интервале:
А) 2, 4 ¸ 3, 7 Б) 6, 4 ¸ 8, 4 В) 8 ¸ 10
Г) 3, 75 ¸ 5, 75 Д) 1 ¸ 10
4. Максимальная буферная емкость наблюдается при соотношении Ссопр. осн. : Скисл. :
А) 1: 1 Б) 1: 10 В) 10: 1 Г) 2: 8 Д) 5: 10
5. Для развития бактерий пневмококка наиболее благоприятны значения рН:
А) 7, 0 ¸ 7, 4 Б) 7, 4 В) 7, 6 ¸ 7, 8
Г) 0, 9 Д) 5, 4 ¸ 6, 9
6. Наибольшая буферная емкость по кислоте у следующего буфера крови:
А) белковый Б) фосфатный В) аминокислотный
Г) аммонийный Д) гидрокарбонатный
7. 2. Узловые вопросы, необходимые для усвоения тем занятия.
1. Протолитическая теория кислот и оснований.
2. Кислотно-основные буферы. Их типы.
3. Расчет pH в буферных растворах.
4. Буферная емкость, ее зависимость от различных факторов и расчет.
5. Буферные системы в организме и кислотно-основный гомеостаз.
7. 3 Самостоятельная работа обучающихся.
7. 3. 1. Лабораторная работа.
Задание 1. Приготовление буферного раствора.
В три пробирки внесите 0, 1 М растворы СН3СООН и СН3СООNa в соотношении (по объему): 9: 1, 5: 5 и 1: 9. Каждый приготовленный раствор хорошо перемешать. Во все три пробирки прибавьте по 3 капли индикатора метилового оранжевого или метилового красного. Сравните и запишите окраску растворов. По известной формуле рассчитайте значения рН во всех трех растворах. В каких пределах изменилось значение рН?
|
|
|
Задание 2. Влияние разбавления на рН буферных растворов.
Приготовьте 3 раствора ацетатного буфера в соотношении 9: 1, 5: 5 и 1: 9 как в предыдущем опыте. Затем в 3 чистые пробирки отберите по 2 мл приготовленных буферных растворов и добавьте в каждую из них по 8 мл дистиллированной воды. Растворы хорошо перемешайте. Во вновь приготовленные растворы (с разбавлением) добавьте по 3 капли индикатора метилового красного как и в первом случае. Сравните окраски растворов между собой и с первыми тремя пробирками. Сделайте заключение по окраске содержимого пробирок. С учетом разбавления исходных растворов вновь рассчитайте значения рН полученных растворов. Результаты наблюдений и расчетов внесите в таблицу по форме и сделайте выводы.
| Номера пробирок | ||||||
| Соотношение кислота: соль в буферном растворе | ||||||
| Окраска растворов после добавления индикатора | ||||||
| Расчетное значение рН |
Задание 3. Определение буферной емкости по кислоте и по щелочи.
В конической колбе приготовьте буферный раствор, смешав 10 мл 0, 1 М СН3СООН и 10 мл 0, 1 М раствора СН3СООNa. В другой колбе приготовьте раствор – свидетель, смешивая 18 мл 0, 1 М СН3СООН и 2 мл 0, 1 М СН3СООNa.
В обе колбы внесите по 3 капли раствора метилового оранжевого. Сравните окраску растворов. Затем содержимое первой колбы титруйте из бюретки 0, 1 М раствором НС1 до получения одинаковой окраски с раствором – свидетелем. Запишите затраченный объем раствора НС1 и рассчитайте по известной формуле буферную емкость ацетатного буфера. Значение рН содержимого 1 и 2 колб берите из расчетных величин 2 и 3 пробирок (см. табл. из пред. задания). Бюретку с 0, 1 М раствором НС1 надо приготовить соблюдая правила ацидометрии параллельно с приготовлением содержимого 1 и 2 колб.
Для определения емкости ацетатного буфера по щелочи надо приготовить колбу с содержанием 10 мл 0, 1 М СН3СООН и 10 мл 0, 1 М СН3СООNa и раствор – свидетель (другая колба), содержащий 18 мл 0, 1 М СН3СООNa и 2 мл 0, 1 М СН3СООН. После добавления 3 капель раствора метилового оранжевого в каждую колбу, содержимое 1-ой колбы титруйте из бюретки 0, 1 М раствором NaOH до одинаковой окраски с раствором – свидетелем. Записав объем затраченного раствора NaOH рассчитайте буферную емкость по щелочи. Значения рН содержимого 1-ой и 2-ой колб берите из расчетных величин 2 и 1 пробирок (см. табл. из пред. задания). Бюретку с 0, 1 М раствором NaOH надо приготовить соблюдая правила алкалиметрии параллельно с приготовлением содержимого 1-ой и 2-ой колб.
|
|
|
Сравните буферную емкость ацетатного буфера по кислоте и по щелочи. Сделайте выводы.
|
|
|


