 |
2. Разбор типовых задач. 3. Задачи для самостоятельной работы. Образец билета выходного контроля. 7.5 Поведение итогов занятия
|
|
|
|
2. Разбор типовых задач
1. Оцените рН раствора, полученного растворением 0, 53 г Na2CO3в10 л воды.
Решение: Найдем концентрацию Na2CO3 в полученном растворе:
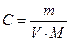 , где
, где
М  =106 г/моль
=106 г/моль

Гидролиз Na2CО3 протекает в 2 стадии:
Na2CО3 + H2O « NaHCO3 + NaOH
NaHCO3 + H2O«NaOH + H2CO3
Т. к., рК1  > > рК2
> > рК2  , учтем только первую стадию гидролиза.
, учтем только первую стадию гидролиза.
рН = 7 + 0, 5рК2  + 0, 5lgС
+ 0, 5lgС 
Из таблицы найдем рК2  =10, 33.
=10, 33.
рН = 7 + 0, 5 × 10, 33 + 0, 5lg5× 10-4 = 7 + 5, 165 – 0, 5 × 3, 3 = 10, 5.
2. Вычислите массу карбоната кальция, находящегося в его насыщенном растворе объемом 3 л.
Решение: Растворение СаСО3 происходит вследствие процесса:
СаСО3 (тв) ↔ Са2+ +СО32-
Обозначим концентрацию ионов Са2+ через х. Тогда
[Ca2+] = [CO32-] = [CaCO3] = х.
Для простоты примем коэффициент активности равный 1, тогда согласно правилу произведения растворимости:
ПР = [Ca2+][CO32-] = х2
Отсюда: х=  =
= 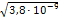 =6, 2·10-5моль/л
=6, 2·10-5моль/л
ПР (CaCO3) = 3. 8•10-9 (из справочника).
Масса СаСО3 будет равна (М =100 г/моль):
m = C •V • M = 6, 2 • 10-5 • 3 •100 = 1, 86 • 10-2 г.
3. Задачи для самостоятельной работы
1. Оцените, какую среду создают водные растворы солей: K2SO3, CrCl3, NaCl, CH3COONH4. При помощи молекулярных и ионных уравнений покажите создаваемую среду в случаях гидролиза.
2. Оцените константу, степень гидролиза и рН полученного раствора при растворении 0, 2 моль Na2S в 2 л воды по первой ступени.
3. Какая из 3-х солей будет подвергаться гидролизу в большей степени (при прочих равных условиях): сульфит натрия, сульфид калия, карбонат цезия по первой ступени. Ответ обоснуйте расчетом.
4. Для сульфата бария величина ПР=1× 10-10. Чему равна молярная растворимость этой соли в его насыщенном растворе? Сколько мг соли содержится в 500 мл этого раствора?
5. Смешали равные объемы 0, 001 М раствора хлорида калия и 0, 5% раствор нитрата серебра. Выпадет ли при этих условиях осадок хлорида серебра, если ПР(AgCl) = 1, 8•10-10, r=1 г/мл?
|
|
|
6. В растворе имеются фосфат- и хлорид- ионы. При введении какого катиона будут наблюдаться: а) выпадение в осадок только одного иона; б) выпадение в осадок обоих ионов?
7. Сколько граммов ионов Ag+ находится в 10 л насыщенного раствора AgBr (ПР=5, 3× 10-13) при комнатной температуре.
8. При какой концентрации СО32- -ионов образуется осадок из 0, 5 моль/л раствора Ca(NO3)2? (ПР = 3, 8× 10-9).
9. Смешали 100 мл 2%-ного раствора K2SO4 (r=1, 02) и 150 мл 5%-ного раствора Pb(NO3)2 (r=1, 04). Выпадет ли осадок? (ПР = 1, 6× 10-8).
10. Раствор ацетата кальция приготовили смешением соли массой 1 г с водой 350 мл. Этот раствор смешали с раствором сульфата натрия с концентрацией 0, 025 моль/л, причем объемы смешиваемых растворов были равны между собой. Образуется ли осадок в этих условиях? (ПР = 2, 5× 10-5)
7. 4. Контроль усвоения темя занятия:
Образец билета выходного контроля
1. рН больше 7 для раствора
1) Ba(NO3)2 2) CuSO4 3) Na2CO3 4) Al2S3
2. Степень гидролиза FeCl3 увеличится при
1)разбавлении 2) охлаждении 3) добавлении кислот
4) нагревании 5) добавлении щелочей
3. Выражение ПР = 4∙ S3 справедливо для
1) Fe(OH)2 2) Fe(OH)3 3)СаCO3 4) Са3(РО4)2
4. Условие выпадения осадка:
1) ПИ < ПР 2) ПИ > ПР 3) ПИ = ПР
5. Элемент, образующий изоморфную смесь в эмали зуба Са10(РО4)6(ОН)2:
1) Cl 2) Na 3) F 4) K
7. 5 Поведение итогов занятия
7. 6. Задание на дом: Буферные растворы.
Место проведения самоподготовки: читальный зал и др.
|
|
|
Литература. [1], [3].
Занятие №4
Тема. Буферные растворы.
1. Актуальность темы . В результате жизнедеятельности в организме ежесуточно образуется большое количество кислот. Во-первых, при усвоении белков, жиров и углеводов образуется углекислота, ежесуточно – 13 моль. Помимо угольной кислоты образуются другие органические и минеральные кислоты, при смешанной диете – до 100 ммоль эквивалента. Например, при усвоении 100 г белка выделяется 60 ммоль эквивалента серной кислоты.
Образование кислот характерно для некоторых патологических процессов. При диабетическом кетозе образуется до 1 моль эквивалента ацетоуксусной и g-оксимасляной кислот. Кислоты в организме образуются и в результате приема внутрь некоторых лекарственных препаратов.
Все выделяющиеся кислоты утилизируются тем или иным способом: кислотные остатки фосфорной кислоты образуют органические фосфаты и входят в состав буферных систем крови и тканей, избыток выводится с мочой. Сульфат-ион образует сложные эфиры, которые выводятся почками. Молочная кислота либо окисляется до СО2, либо превращается в гликоген.
Физико-химические расчеты показывают, что 0, 15 моль СО2 достаточно для того, чтобы нарушить кислотно-основное равновесие организма человека массой 75 кг. Однако в норме организм способен утилизировать до 13 моль выделяющегося ежесуточно СО2 без нарушения кислотно-основного равновесия. В этом наряду с физиологическими механизмами важную роль играют физико-химические механизмы. Среди последних важное значение имеет буферное действие, которое обеспечивается такими буферными системами, как гидрокарбонатная, гемоглобиновая, фосфатная и белковая. При нарушении кислотно-основного равновесия в организме уже через 10-15 минут включается буферная компенсация, которая затем подключает почечную и легочную компенсацию.
2. Учебные цели. Ознакомиться приготовлением и определением емкости буферных растворов как систем, обеспечивающих кислотно-основный гомеостаз в живых организмах.
Для формирования профессиональных компетенций обучающийся должен знать:
· понятия кислотность и основность;
· расчетные формулы активной и общей кислотности в растворах солей, кислот и оснований;
|
|
|
· кислотно-основной гомеостаз в организме.
уметь:
· проводить расчеты pH и pOH в растворах кислот, оснований и солей;
· переходить от одной концентрации к другой, рассчитывать молярную концентрацию;
· логарифмировать и брать антилогарифмы.
владеть:
· методами самостоятельной работы со справочной литературой;
· техникой безопасности при работе с растворами кислот, щелочей и стеклянной посудой;
· навыками выполнения расчетных задач.
|
|
|


