 |
Примеры решения задач. Раздел 4. РАСТВОРЫ
|
|
|
|
Примеры решения задач
Пример 3. 1. Как изменится скорость прямой реакции (Т = const) для следующих процессов:
а) 2SO2(г) + O2(г) ⇄ 2SO3(г),
б) С(графит) + О2(г) = СО2(г),
при увеличении общего давления в реакционном сосуде в три раза?
Решение. Согласно уравнению Менделеева˗ Клапейрона р= CRT (где С ˗ концентрация в моль/л) следует, что при повышении давления в 3 раза, концентрация газообразных веществ увеличивается также в 3 раза.
Согласно закону действующих масс, скорость прямой реакции до повышения давления для реакции а):
а)  =
=  [SO2]2[O2].
[SO2]2[O2].
После повышения давления в 3 раза:
 =
=  (3[SO2])2(3[O2]) = 27
(3[SO2])2(3[O2]) = 27  [SO2]2[O2]. Таким образом, скорость прямой реакции возрастет в 27 раз;
[SO2]2[O2]. Таким образом, скорость прямой реакции возрастет в 27 раз;
Для реакции б):
б)  =
=  [O2], концентрация твердых веществ в выражение скорости не включается. После повышения давления в 3 раза концентрация кислорода увеличится в 3 раза. Таким образом, скорость прямой реакции
[O2], концентрация твердых веществ в выражение скорости не включается. После повышения давления в 3 раза концентрация кислорода увеличится в 3 раза. Таким образом, скорость прямой реакции  =
=  3[O2]= 3
3[O2]= 3  [O2] возрастет в 3 раза.
[O2] возрастет в 3 раза.
Пример 3. 2. Для реакции:
2 С(графит) + Н2(г) = С2Н2(г), DH0х. р. = 226, 75 кДж.
1. Написать математическое выражение констант равновесия Кс и Кр и найти соотношение между ними.
2. Указать, как влияет на концентрацию ацетилена в равновесной смеси: а) повышение температуры; б) снижение давления (T=const);
в) увеличение весового количества графита; г) введение катализатора.
Р ешение
1. Реакция синтеза ацетилена является гетерогенным процессом и протекает на границе раздела твердой и газообразной фазы. Концентрация твердой фазы – графита является постоянной величиной, и константа равновесия данной реакции представляет собой отношение равновесных концентраций ацетилена и водорода:
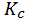 ==[ С2Н2] / [Н2]
==[ С2Н2] / [Н2]  .
.
Соотношение между Кс и Кр находим из уравнения (4. 10), учитывая изменение числа молей газообразных веществ в ходе реакции (Dn =1–1 = 0):
|
|
|
Кр = Кс (RT)∆ п (RT)0= 1 Кр=Кс
2. Направление смещение равновесия при изменении одного из условий равновесия определяется принципом Ле Шателье:
а) данная реакция является эндотермическим процессом (DH0 > 0), подвод тепла извне компенсируется его поглощением в эндотермическом процессе, и равновесие смещается в направлении протекания прямой реакции, что приведет к увеличению концентрации ацетилена в равновесной смеси;
б) увеличение давления приводит к увеличению молярной концентрации газообразных веществ (водорода и ацетилена), таким образом, концентрация ацетилена возрастает, хотя смещения равновесия не происходит, так как протекание данной реакции не сопровождается изменением числа молей газов Dν = 0;
в) данная система является гетерогенной; концентрация твердых веществ в выражение скорости не включается, поэтому весовое количество графита не влияет на смещение равновесия, а, следовательно, и на величину концентрации ацетилена;
г) введение катализатора сокращает время достижения равновесия, но не влияет на его смещение. Следовательно, равновесная концентрация ацетилена в присутствии катализатора остается постоянной.
Раздел 4. РАСТВОРЫ
Растворы – это гомогенные системы, состоящие из двух и более компонентов, состав которых можно изменять в определенных пределах без нарушения гомогенных свойств. Образование растворов сопровождается значительными объемными и тепловыми эффектами, что напоминает образование химических соединений.
Растворы не имеют постоянного состава и к ним не применимы законы стехиометрии.
Структура и свойства растворов определяются природой и размером растворенных частиц, агрегатным состоянием системы и др.
Размеры растворенных частиц определяют степень дисперсности системы. По возрастанию величины степени дисперсности различают грубодисперсные системы (радиус частиц 10-5˗ 10-7м), коллоидные системы (радиус частиц 10-7-10-9 м), истинные растворы (размер молекул или ионов 10-9-10-10 м).
|
|
|
Грубодисперсные и коллоидные системы состоят из двух или более фаз, одна из которых состоит из отдельных мелких частиц (дисперсная фаза), распределенных в другой фазе (дисперсионной среде).
Грубодисперсные системы разделяют на суспензии (твердые частицы в жидкости) и эмульсии (капли одной жидкости в другой). Типичной суспензией является система, полученная взбалтыванием глины в воде, а типичной эмульсией – молоко.
Коллоидные системы являются промежуточными между истинными растворами и грубодисперсными системами.
Коллоидная система – это система, в которой твердые частицы, капли или пузырьки дисперсной фазы распределены в другой фазе, отличающейся от первой по составу или агрегатному состоянию. Примерами коллоидных систем являются водные растворы клея или желатина, туман (капли жидкости в газе), дым (твердые частицы в газе). Наиболее характерным отличием коллоидных растворов от истинных растворов является то, что их более крупные частицы сильно рассеивают проходящий через них свет. Для коллоидных систем характерно матовое (обычно голубоватое) свечение, которое можно наблюдать на темном фоне при пропускании через них пучка света. Это свечение называется опалесценцией. Опалесценция наблюдается только тогда, когда длина световой волны больше размера частицы дисперсной фазы. Если длина волны намного меньше, происходит отражение, проявляющееся в виде мути.
Истинные растворы подразделяют на газообразные (воздух), жидкие (морская вода) и твердые (сплавы).
При нормальном давлении из-за слабого взаимодействия между молекулами газовые растворы можно считать механической смесью компонентов, однако размеры молекул газов позволяют отнести их к истинным растворам.
Твердые растворы – это системы с переменным составом, в которых частицы различных элементов располагаются в общей кристаллической решетке. Область существования твердых растворов обычно отличается достаточно узкими интервалами концентраций. Однако такие металлы, как медь и золото, обладают практически полной взаимной растворимостью. Различают твердые растворы замещения и внедрения. В первых структурные единицы (атомы, ионы, молекулы) растворяющегося компонента замещают частицы растворителя в узлах кристаллической решетки. Этот случай характерен для веществ, имеющих близкие размеры частиц и однотипные кристаллические решетки. Если же эти условия не соблюдаются, то могут образовываться твердые растворы внедрения. В этом случае происходит внедрение структурных единиц растворяемого компонента в междоузлия кристаллической решетки растворителя.
|
|
|
Жидкие растворы, как и все прочие, состоят из растворителя и растворенного вещества. В жидких растворах наиболее типичным и широко распространенным растворителем является вода. По характеру распределения электронной плотности между атомами кислорода и водорода молекулы воды являются полярными. Полярные молекулы называют диполями.
|
|
|


