 |
Таблица 4.1. Цвета кислотно-основных индикаторов в зависимости от рН раствора. Шкала рН. Равновесие в растворах труднорастворимых веществ
|
|
|
|
Таблица 4. 1
Цвета кислотно-основных индикаторов в зависимости от рН раствора
|
Индикатор |
Шкала рН | ||||||||||||||
| Метиловый оранжевый |
| красный | желтый | ||||||||||||
| Лакмус | красный | фиолетовый | синий | ||||||||||||
| Фенолфталеин | Бесцветный | малиновый | |||||||||||||
Использование индикаторов позволяет только приблизительно оценить рН раствора. Для более точного измерения кислотности среды используются приборы, называемые рН-метры.
Равновесие в растворах труднорастворимых веществ
Вещества, в зависимости от своей природы, обладают различной растворимостью в воде, которая колеблется от долей миллиграмма до сотен граммов на литр. Трудно растворимые вещества образуют насыщенные растворы очень маленьких концентраций, поэтому можно считать, что степень их диссоциации достигает единицы. Таким образом, насыщенный раствор труднорастворимого электролита представляет собой систему, состоящую из раствора, находящегося в равновесии с осадком растворенного вещества. При постоянных внешних условиях скорость растворения осадка равна скорости процесса кристаллизации:
Кtnm+Аmn-(кристалл) ⇄ nКtm+(раствор) + mАn- (раствор).
В насыщенном растворе труднорастворимого соединения устанавливается гетерогенное равновесие, характеризующееся константой равновесия:
Кс = 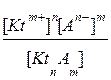 .
.
Так как концентрация вещества КtnАm в твердой фазе величина постоянная [КtnАm] = const, то ее можно объединить с константой равновесия и получить новую константу. Константа равновесия в системе осадок/насыщенный раствор называется произведение растворимости (ПР):
|
|
|
| ПР = [Кtm+]n [ Аn--]m. | (4. 14) |
Произведение растворимости зависит только от природы растворенного вещества и температуры. Для многих труднорастворимых веществ ПР определено и сведено в справочные таблицы. Чем меньше величина ПР, тем меньше ионов переходит в раствор и тем меньше растворимость вещества.
Концентрация вещества в насыщенном растворе характеризует его способность растворяться в данном растворителе. Эту концентрацию принято называть растворимостью. Растворимость веществ колеблется в очень широких пределах. Так, например, в 100г воды может раствориться до 200г глюкозы, а иодида серебра только 1, 3∙ 10-7г.
Зная величину ПР, можно рассчитать растворимость вещества, т. е., его концентрацию в насыщенном растворе (S, моль/л):
S = 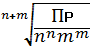 , ,
| (4. 15) |
где S – растворимость вещества в моль/л; n и m стехиометрические коэффициенты в уравнении. В справочной литературе растворимостью (S) называется концентрация насыщенного раствора, выраженная в г растворенного вещества на 100 г воды.
Из понятия ПР вытекает условие выпадения осадка: до тех пор, пока произведение концентраций ионов в растворе не превысит величину ПР данной соли ([К+m]n[А-n]m < ПР), вещество в осадок выпадать не будет.
Это утверждение справедливо лишь для случая, когда в растворе присутствует только одно растворенное вещество. При добавлении к насыщенному раствору труднорастворимого соединения еще одного электролита, содержащего одноименный ион, равновесие сдвинется в сторону процесса кристаллизации (влево), что позволит более полно выделить растворенное вещество из жидкой фазы в твердую.
Реакции ионного обмена
Реакции между электролитами в растворе – это реакции обмена ионами. Обменные реакции протекают без изменения зарядов ионов и обычно имеют большую скорость. Обязательным условием протекания таких реакций является удаление из раствора тех или иных ионов. Обменные реакции записываются с помощью молекулярных уравнений (МУ), полных ионно-молекулярных уравнений (ИМУ) и сокращенных ионно-молекулярных уравнений (сокр. ИМУ). Рассмотрим четыре типичных варианта обменных реакций, идущих практически до конца (т. е. равновесие смещено в сторону продуктов реакции):
|
|
|
1. Реакции, идущие с образованием осадка
Например, при смешении растворов сульфата железа и хлорида бария, которые относятся к хорошо растворимым веществам, образуется осадок сульфата бария. Молекулярное уравнение этой реакции:
FeSO4(р) + BaCl2(р) = FeCl2(р) + BaSO4¯ (ПРBaSO4=1, 1× 10-10) (МУ)
Запишем реакцию в виде ионно-молекулярного уравнения:
Fe2++SO42-+Ba2++2Cl-® Fe2+ + 2Cl- + BaSO4 (ИМУ)
После сокращения в левой и правой частях ИМУ одинаковых ионов, получаем сокращенное ИМУ:
SO42-+Ba2+-® BaSO4 (сокр. ИМУ)
Так как BaSO4 выпадает в осадок, который не участвует в обратной реакции растворения, то и равновесие данного процесса смещено вправо и реакция практически идет до конца.
2. Реакции, идущие с выделением газа
Например, взаимодействие концентрированных растворов хлорида натрия и серной кислоты приводит к образованию газообразного хлористого водорода:
NaCI(р) + H2SО4(р) = HCl(г) + NaHSО4(р), (МУ)
Na+ + Cl- + Н+ +НSO4- = HCl(г) + Na+ + HSO4- , (ИМУ)
Н+(р) + Cl-(р) =HCl(г). (сокр. ИМУ)
|
|
|


