 |
Образование растворов. 5.2. Способы выражения концентраций растворов
|
|
|
|
Образование растворов
Образование растворов – это сложный избирательный процесс. В процессе растворения веществ изменяется как их структура, так и структура растворителя. Частицы вступают в новые типы взаимодействий, при этом изменяется состояние системы в целом. Физико-химический процесс взаимодействия молекул растворителя и молекул, ионов или атомов растворяемого вещества, в результате которого образуются сложные пространственные структуры, называется сольватацией (если растворитель вода ˗ гидратацией ), а сами структуры сольватами (гидратами).
Процесс растворения является самопроизвольным процессом и протекает с убылью свободной энергии (DG< 0):
| Δ G0раств. = Δ H0раств. –TΔ S0раств. | (4. 1) |
Тепловой эффект, наблюдаемый при растворении, следует рассматривать как результат ряда физических и химических явлений:
1. Разрушение химических и межмолекулярных связей в растворяющихся веществах. При растворении в воде жидких и твердых веществ теплота может выделяться (например, растворение KOH, Ca(OH)2, серной кислоты) или поглощаться (например, растворение NaNO3, KI). В общем случае изменение энтальпии для обоих случаев обозначим как DН1.
2. Физико-химическое взаимодействие растворяющегося вещества с молекулами растворителя с образованием сольватных структур. Этот процесс сопровождается выделением энергии и, значит, энтальпия системы понижается, т. е. DН2< 0.
3. Самопроизвольное перемешивание раствора, в результате которого концентрация сольватных структур по объему раствора выравнивается. Этот процесс требует небольших затрат энергии (DH3> 0). Вклад этой составляющей в общий тепловой эффект незначителен.
|
|
|
Таким образом, суммарный тепловой эффект процесса растворения складывается из трех составляющих:
DНраств. = DН1+ DН2+ DН3.
В зависимости от соотношения этих трех величин суммарный тепловой эффект может быть как положительным, так и отрицательным.
Если растворение является процессом экзотермическим (Δ H0раст. < 0), то в соответствии с уравнением (5. 1) возможны два варианта: Δ S0раств. > 0 и Δ S0раств. < 0. Например, при растворении газов энтропия системы убывает (Δ S0раств. < 0) и в процессе растворения превалирует энтальпийный фактор.
Если же процесс растворения происходит с поглощением теплоты (Δ H0раст. > 0), то процесс растворения может протекать за счет энтропийного фактора.
В процессе растворения растворы называются ненасыщенными. В момент, когда энтальпийный и энтропийный факторы выравниваются, наступает состояние равновесия и раствор становится насыщенным. В этом состоянии избыток растворяемого вещества и раствор могут сосуществовать сколь угодно долго.
Если процесс растворения твердого вещества проводить при повышенной температуре до состояния насыщения, а затем медленно его начать охлаждать, то можно создать условия, при которых избыточное количество растворенного вещества в осадок выпадать не будет. Такой раствор называют пересыщенным. Пересыщенный раствор находится в состоянии неустойчивого равновесия и при малейшем воздействии разрушается.
5. 2. Способы выражения концентраций растворов
Концентрация является количественной характеристикой состава раствора. Под концентрацией понимают содержание растворенного вещества в определенной массе или в определенном объеме раствора или растворителя. Для выражения состава растворов чаще всего используются массовая доля растворенного вещества (w, %), молярная концентрация (молярность, См), нормальная (нормальность, Сн).
|
|
|
Массовая доля (ω ) представляет собой отношение массы раст-воренного вещества (mв-в, , г) к массе всего раствора (mр-ра, г):
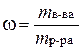 . .
| (4. 2) |
Это безразмерная величина, выражаемая в долях от единицы или в процентах: 
 ω, % =
ω, % = 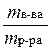 ∙ 100%.
∙ 100%.
Массовая доля численно равна числу граммов вещества, растворенного в 100г раствора. Например, 20% NaCl означает, что в 100г раствора содержится 20г хлорида натрия (т. е. 100г раствора содержит 20г NaCl и 80г Н2О).
Молярность (М или СМ ) – число молей растворенного вещества в 1л раствора. Молярность рассчитывают по формуле:
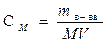 , моль/л, , моль/л,
| (4. 3) |
где mв-ва – масса растворенного вещества (г); М – молярная масса растворенного вещества ( г/моль); V – объем раствора (л).
Например, 1 литр 0, 1М H2SO4 (или CM = 0, 1 моль/л) раствора содержит 0, 1 моля H2SO4 или m =n∙ МH2SO4= 0, 1∙ 98 г/моль = 9, 8г.
Нормальность (н или Сн ) – число эквивалентов растворенного вещества в 1л раствора. Нормальность рассчитывают по формуле:
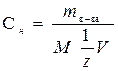 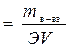 моль/л, моль/л,
| (4. 4) |
где mв-ва ˗ масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль); V – объем раствора (л); 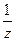 = fэкв – фактор эквивалентности, безразмерная величина.
= fэкв – фактор эквивалентности, безразмерная величина.
Например, для H2SO4 (z = 2 число атомов водорода в формуле); H3PO4 (z =3); NaOH (z = 1число групп ОН в формуле ); Ca(OH)2 (z = 2); AlCl3 (z = 3); Al2(SO4)3 (z = 2∙ 3=6 валентность металл. на число атомов металла в формуле ); NH4Cl (z = 1)
Таким образом, 0, 01н H2SO4 (или Cн=0, 01 моль/л) – это раствор в одном литре которого содержится 0, 01 моль эквивалента H2SO4.
Нормальная концентрация связана с молярной концентрацией соотношением:
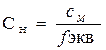 . .
| (4. 5) |
|
|
|


