 |
Растворы электролитов.. Теория электролитической диссоциации
|
|
|
|
Растворы электролитов.
Теория электролитической диссоциации
По признаку электрической проводимости растворы делятся на электролиты и неэлектролиты. Например, при растворении в воде поваренной соли (NaCl) образуется проводящий электрический ток раствор, а при растворении сахара С12Н22О11 – непроводящий. При растворении электролитов в раствор переходят заряженные частицы – ионы, а неэлектролитов – нейтральные молекулы вещества.
Электролиты – это вещества, растворы или расплавы, которых проводят электрический ток за счет движения ионов. Электролиты относятся к проводникам второго рода. Для растворов электролитов наблюдаются отклонения от законов Рауля и Вант Гоффа.
Различия в свойствах растворов, проводящих и не проводящих электрический ток, впервые были объяснены в рамках теории, электролитической диссоциации.
Теория электролитической диссоциации базируется на трех постулатах:
Первый постулат. Некоторые вещества, называемые электролиты, обладают способностью при растворении распадаться на противоположно заряженные частицы, называемые ионами.
Процесс распада веществ на ионы под действием растворителяназывается электролитической диссоциацией .
Величина и знак заряда ионов, а также их число зависят от природы электролита. Различают три типа электролитов:
1. Бинарные – распадаются на два иона. Например, NaCl, ZnSO4:
NaCl ↔ Na+ + Cl-; ZnSO4 ↔ Zn2+ + SO42-.
2. Тернарные – распадаются на три иона. Например, Na2SO4, CaCl2:
Na2SO4↔ 2Na+ + SO42-; CaCl2 ↔ Ca2+ + 2Cl-.
3. Квартернарные – распадаются на четыре иона. Например: K3PO4, Al(NO3)3:
K3PO4 ↔ 3K+ + PO43- , Al(NO3)3 ↔ Al3+ + 3NO3-.
Второй и третий тип электролитов являются несимметричными.
|
|
|
Второй постулат. Электролиты при растворении распадаются на ионы не полностью, и поэтому только часть молекул присутствует в растворе в виде ионов.
Величина, характеризующая долю молекул, распавшихся на ионы в состоянии равновесия, называется степенью диссоциации (a):
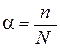 , ,
| (4. 6) |
где n – число распавшихся на ионы молекул; N – общее количество растворенных молекул.
Степень диссоциации зависит от температуры, типа растворителя, от природы электролита и его концентрации. По значению степени диссоциации электролиты разделяют на сильные, слабые и средней силы. Принято считать, что в 0, 1н растворах, для сильных электролитов a > 0, 3; для слабых a < 0, 03.
К сильным электролитам в водных растворах относятся почти все хорошо растворимые соли, гидроксиды щелочных и щелочно-земельных металлов, многие неорганические кислоты (HCl, H2SO4, HNO3, HBr, HI и др. ).
Второй количественной характеристикой электролита является константа диссоциации Кд, которая является константой равновесия в процессе электролитической диссоциации:
KnAm ⇄ nKm+ + mAn-
КД = 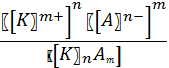 . .
| (4. 7) |
Уравнение (4. 7) справедливо лишь для слабых разбавленных электролитов.
В случае концентрированных растворов и растворов сильных электролитов следует учитывать различного рода взаимодействия между частицами в растворе. Для учета этих взаимодействий было предложено заменить концентрацию вещества на его активность:
| а = f C, | (5. 11) |
где f – коэффициент активности (0< f< 1), который формально учитывает все виды взаимодействий между частицами в растворе. С учетом этого, уравнение (5. 11) имеет вид:
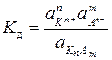 . .
| (4. 8) |
Константа диссоциации, в отличие от степени диссоциации, не зависит от концентрации и определяется природой электролита и температурой. Константа диссоциации представляет собой важную характеристику слабых электролитов, чем меньше ее значение, тем слабее электролит.
|
|
|
Для бинарного слабого электролита: АВ Û А+ + В- взаимосвязь константы диссоциации, степени диссоциации и концентрации выражается законом разведения Оствальда:
Кд= 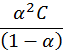 . .
| (4. 9) |
Для очень слабых электролитов a→ 0, поэтому в знаменателе ею можно пренебречь, и выражение (5. 13) преобразуется в более простое:
| Кд= a2С. | (4. 10) |
Соотношение (4. 10) справедливо только для слабых симметричных бинарных электролитов. В более сложных случаях это выражение усложняется.
Условно можно принять, что если Кд < 10-3, электролит считается слабым. К слабым электролитам относится Н2О, пероксид водорода (Н2О2), гидроксид аммония (NH4OH), некоторые неорганические кислоты, например, H2S, HCN, H2CO3.
Третий постулат. Взаимодействие между ионами отсутствует, и растворы электролитов ведут себя подобно идеальным.
На этом постулате основываются все количественные соотношения теории. Именно этот постулат определил границы применимости теории для количественных расчетов. Уравнения могут быть использованы только для очень разбавленных растворов, в которых ион-ионное взаимодействие стремится к нулю.
|
|
|


