 |
Зависимость скорости реакции от температуры
|
|
|
|
В подавляющем большинстве химических реакций с ростом температуры их скорость увеличивается.
Существует эмпирическое правило, по которому скорость большинства гомогенных химических реакций при повышении температуры на 100С возрастает примерно в 2-4 раза.
Эта зависимость была описана Вант-Гоффом и носит его имя:
 , ,
| (3. 5) |
где V1 и V2 – соответственно скорости реакции при Т1 и Т2; g – температурный коэффициент, равный 2¸ 4.
Однако это уравнение теоретически не обосновано и, в реакциях с участием больших по молекулярной массе молекул, не всегда справедливо.
Необходимым условиемдля начала химической реакции между двумя частицами является их соударение. Но не каждый акт столкновения молекул реагирующих веществ приводит к их химическому взаимодействию. Это можно объяснить тем, что часть молекул, не обладая достаточным запасом кинетической энергии, при столкновении упруго отталкиваются за счет межмолекулярных сил, и в реакцию не вступают.
Таким образом, столкновение частиц является необходимым условием, но не является достаточным для их химического взаимодействия.
Шведский ученый С. Аррениус высказал гипотезу о том, что в химическую реакцию вступают только те молекулы, уровень энергии которых выше энергии отталкивания между молекулами при их сближении. Тем самым он ввел понятие энергетического барьера химической реакции.
Все молекулы, энергия которых равна или выше энергетического барьера, находятся в особом состоянии, называемом активированным комплексом. Это состояние является переходным. В нем как бы уже нет исходных веществ, но нет и еще продуктов реакции.
Рассмотрим образование активированного комплекса на примере реакции:
|
|
|
А2 + В2 = 2 АВ.
Очевидно, что реакция произойдет только тогда, когда соударяются активные молекулы с энергией, достаточной для разрыва (или существенного ослабления) химических связей. Следует иметь в виду, что на разрыв связей в химическом соединении требуется энергия и, наоборот, при образовании связей энергия выделяется. При столкновении молекул А2 и В2, обладающих достаточной энергией, в них начинается перестройка: связи в исходных молекулах ослабляются, но окончательно не разрываются. Одновременно с этим идет образование связей между самими молекулами А2 и В2, которое приводит к выделению энергии. Все это приводит к образованию некоторого промежуточного или переходного состояния. Переходное состояние системы отвечает образованию активированного комплекса (А2В2):
начальное состояние → переходное состояние → конечное состояние
 А А А А
 + +
 В В
Исходные реагенты В В
Исходные реагенты
|  А А А А
Активированный комплекс | А А
  +
В В
Продукты реакции +
В В
Продукты реакции
| |||||||||||||||
Молекулы в переходном состоянии обладают максимально возможным запасом энергии и поэтому они крайне неустойчивы. Время жизни активированного комплекса составляет порядка 10-13с. Распад активированного комплекса приводит к образованию продуктов реакции либо исходных веществ.
Энергия, необходимая для образования активированного комплекса, называется энергией активации (Еа).
Энергетические изменения для простой одностадийной реакции системе можно представить в виде схемы, изображенной на рис 3. 1. По оси ординат отложена потенциальная энергия системы. Ось абсцисс характеризует реакционный путь реакции:
исходное состояние → переходное состояние → конечное состояние.
Исходное состояние имеет энергию, равную Ʃ Δ Н0нач. , конечное Ʃ Δ Н0кон. . Разность этих энергий равна тепловому эффекту реакции:
|
|
|
Δ Н0х. р. = Ʃ Δ Н0кон. ˗ Ʃ Δ Н0нач. .

Рис. 2. 1. Энергетическая диаграмма одностадийной реакции: А2 + В2 =2АВ:
а – эндотермическая реакция; б – экзотермическая реакция
Энергия активированного комплекса выше энергии исходного и конечного состояния. Обратная реакция также протекает через образование активированного комплекса, но величина энергии активации ( 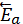 ) иная, чем в прямой реакции. Разность между энергиями активации прямой и обратной реакции соответствует тепловому эффекту реакции:
) иная, чем в прямой реакции. Разность между энергиями активации прямой и обратной реакции соответствует тепловому эффекту реакции:
Δ Н0х. р. =  - -  . .
| (3. 6) |
Если энергия активации прямой реакции больше чем обратной, то реакция экзотермическая, в противном случае – эндотермическая.
Энергия активации измеряется в кДж/моль и для большинства реакций изменяется в пределах от 50 до 250 кДж/моль. Считается, что реакции, у которых Еа> 150 кДж/моль, при стандартных условиях практически не протекают. Энергия активации расходуется на преодоление отталкивания между частицами и на ослабление химических связей у исходных веществ. Таким образом, энергия активации косвенно характеризует природу реагирующих веществ, так как отражает прочность химической связи в них.
Влияние температуры и природы реагирующих веществ на скорость химической реакции описывается уравнением Аррениуса, которое связывает константу химической реакции с энергией активации и температурой:
| К = А0 е- | (4. 7) |
где А0 – предэкспоненциальный множитель; Еа, кДж/моль – энергия активации; R–универсальная газовая постоянная (8, 314 Дж/моль∙ К); Т, К – абсолютная температура.
Множитель А0 является постоянной или очень мало зависящей от температуры величиной (для данной реакции). А0 отражает общее число столкновений частиц в единицу времени, а также вероятность распада активированного комплекса на исходные вещества. Фу  характеризует долю частиц, обладающих энергией, достаточной для вступления в реакцию (долю активных молекул).
характеризует долю частиц, обладающих энергией, достаточной для вступления в реакцию (долю активных молекул).
Из уравнения Аррениуса следует, что при постоянной температуре константа скорости определяется величиной энергии активации. Чем выше Еа, тем меньше в реакционной смеси активных молекул, тем меньше константа скорости и сама скорость химической реакции.
|
|
|
|
|
|






 В В
В В