 |
Окислительно-восстановительные реакции
|
|
|
|
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Одним из вариантов классификации химических реакций может быть разделение их на две большие группы: реакции, протекающие без изменения степени окисления и окислительно-восстановительные реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. В таких реакциях столкновение частиц сопровождается переходом электронов от одного из реагентов к другому.
Для окислительно-восстановительных реакций в отечественной литературе используется сокращение ОВР, а в иностранной Redox от латинских восстановление (reduction), окисление (oxdation).
Окислительно-восстановительные реакции очень широко распространены в природе. К ним относятся реакции фотосинтеза у растений, дыхание живых организмов, процессы горения и коррозии металлов и многие другие.
Степень окисления
Степень окисления является характеристикой окислительно-восстановительной способности частиц.
Под степенью окисления элемента понимают электрический заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов. В отличие от реально существующих зарядов у ионов, степень окисления показывает лишь возможный заряд атома в молекуле. Она может быть отрицательной, положительной и нулевой. Например, степень окисления атомов в простых веществах равна «0» (
2. Степень окисления атома фтора равна «-1» (  );
);
3. Водород проявляет во всех соединениях степень окисления «+1», за например,  ,
,  ,
,  ,
,  ).
).
Степень окисления – это формальная величина, но несмотря на это, ее использование является эффективным при подборе коэффициентов в ОВР.
Для нахождения степеней окисления используют следующие правила:
|
|
|
1. Металлы главных подгрупп I, II и III групп обладают в химических соединениях постоянной степенью окисления, соответствующей номеру группы (например,  ,
,  ,
,  ); исключением гидридов щелочных и щелочно-земельных металлов, в которых степень окисления водорода равна «–1» (например, (
); исключением гидридов щелочных и щелочно-земельных металлов, в которых степень окисления водорода равна «–1» (например, (  ,
,  );
);
4. Степень окисления кислорода в соединениях равна «-2», кроме пероксидов, в которых степень окисления равна «-1» (например, 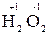 ,
, 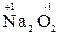 ).
).
5. Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона. Эта взаимосвязь позволяет рассчитывать степени окисления атомов в сложных соединениях.
В химических соединениях атомы многих элементов могут иметь переменную степень окисления. Например, сера в различных соединениях может проявлять степень окисления «-2, 0, +2, +4, +6». В таких случаях для нахождения степени окисления атома необходимо воспользоваться изложенными ранее правилами. Конкретно, для определения степени окисления серы в молекуле серной кислоты  следует исходить из того, что молекула нейтральна. Атом водорода имеет степень окисления +1, а атом кислорода -2. Так как атомов водорода два, а атомов кислорода четыре, то мы имеем два «+» и восемь «-». До нейтральности не хватает шесть «+». Именно это число и является степенью окисления серы
следует исходить из того, что молекула нейтральна. Атом водорода имеет степень окисления +1, а атом кислорода -2. Так как атомов водорода два, а атомов кислорода четыре, то мы имеем два «+» и восемь «-». До нейтральности не хватает шесть «+». Именно это число и является степенью окисления серы  .
.
Изменение степени окисления элементов происходит за счет перехода электронов от одних частиц к другим. В химии условный заряд электрона принят за величину «-1» и обозначается 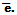 Например, в реакции вытеснения меди из раствора ее соли:
Например, в реакции вытеснения меди из раствора ее соли:
CuSO4(р-р) + Zn(к) = Cu(к) + ZnSO4(р-р), Δ G0298= - 212 кДж
электроны от атома цинка переходят к ионам меди:
Zn(к) + Cu2+(р-р) = Zn2+(р-р) + Cu(к)
Процесс потери частицей электронов называется окислением, а процесс присоединения электронов – восстановлением:
Zn – 2е  → Zn2+ процесс окисления
→ Zn2+ процесс окисления
Восстановитель
|
|
|
Сu2+ + 2е  → Cu процесс восстановления
→ Cu процесс восстановления
Окислитель
Частица, отдающая электроны, называется восстановитель ( Red ), а частица, которая эти электроны присоединяет – окислитель ( Оx ).
В этой реакции цинк повышает степень окисления, а медь – понижает.
Окислительно-восстановительная реакция ˗ это единый процесс, состоящий из двух полуреакций: полуреакции окисления и полуреакции восстановления, которые протекают одновременно.  Схемы полуреакций окисления и восстановления можно представить следующим образом:
Схемы полуреакций окисления и восстановления можно представить следующим образом:
Red - nе = Red+n – окисление восстановителя
Ox + nе  = Ox-n – восстановление окислителя
= Ox-n – восстановление окислителя
 Red + Ox = Red+n + Ox-n
Red + Ox = Red+n + Ox-n
Последняя реакция является суммарной ОВ-реакцией, в которой отданные и принятые электроны при сложении сократились, т. к. количество отданных и принятых электронов должно совпадать. Если восстановитель отдает два электрона, а окислитель может принять только один, то число участвующих в реакции частиц окислителя должно быть удвоено.
|
|
|


