 |
Химическая коррозия. Электрохимическая коррозия. Талица 7.1. Катодные реакции восстановления кислорода в зависимости от рН среды
|
|
|
|
Химическая коррозия
При химической коррозии происходит прямое гетерогенное окисление металлов агрессивной средой. Окислитель забирает у металла валентные электроны и образует с ним химическое соединение. В результате на поверхности металла образуется пленка из продукта коррозии. Чисто химический механизм коррозии встречается достаточно редко. Чаще всего химическая коррозия протекает при взаимодействии металлов с сухими газами (например, O2, Cl2, CO2, NO2) при высоких температурах (газовая коррозия) и в растворах неэлектролитов (например, нефть и продукты ее переработки, содержащие соединения серы, а также жидкие галогены). Наиболее распространенным случаем газовой коррозии является взаимодействие металла с кислородом воздуха с образованием оксидного слоя различного состава и различной толщины. Например, в реакциях: а) 4Al+3О2 = 2Al2O3; б) 4Fe+3О2 = 2Fe2O3, кислород, отнимая валентные электроны у алюминия и железа, образует на поверхности металлов оксидные пленки (Fe2О3, А12О3).Помимо оксидных пленок продуктами газовой коррозии в присутствии Н2S и CO2 могут быть сернистые соединения, основные соли угольной кислоты (например, Ag2S, (СuОН)2СO3).
Сильными окислителями для металлов являются галогены. Так, например, алюминий и его сплавы, хром и стали с высоким содержанием хрома не устойчивы в атмосфере хлора. А жидкий бром активно окисляет алюминий, титан, железо, сталь и никель.
По химическому механизму протекает коррозия металлов в неэлектролитах за счет агрессивных органических жидкостей, например, сернистой нефти:
R1R2S + Me = MeS + R1R2.
Электрохимическая коррозия
Механизм электрохимической коррозии связан с возникновением микрогальванопар (т. е. появлением анодных и катодных участков у корродирующего металла) или макрогальванопар (контактная коррозия), сопровождается возникновением в системе электрического тока и протекает в средах, проводящих электрический ток (растворах или расплавах электролитов). Таким образом, процессы, протекающие при электрохимической коррозии, аналогичны процессам, протекающим в гальваническом элементе, за исключением того, что электроны движутся внутри корродирующего металла, т. е. отсутствует внешняя цепь.
|
|
|
Причиной коррозии является термодинамическая неустойчивость металла в коррозионной среде. Мерой этой неустойчивости служит изменение энергии Гиббса:
| ∆ G = -nFE < 0, | (7. 1) |
где n – число электронов, принимающих участие в коррозионном окислительно-восстановительном процессе; F = 96500Кл ˗ число Фарадея; Е= Ек - Еа – ЭДС коррозионного гальванического элемента, а Ек, Еа –потенциалы соответственно катодного и анодного процессов, В. Отсюда следует, что электрохимическая коррозия будет происходить при условии, что в растворе присутствует окислитель, равновесный потенциал которого более положительный, чем равновесный потенциал металла, который выступает анодным участком.
Окислитель, обеспечивающий протекание катодного процесса, называется деполяризатором, а сам процесс отвода электронов с катодных участков называется деполяризацией.
Чаще всего в качестве деполяризаторов выступают растворенные в электролите или в воде молекулярный кислород или ионы водорода. Вследствие этого следует различать два вида электрохимической коррозии:
1) с кислородной деполяризацией
Потенциал кислородного электрода зависит от рН среды по уравнению:
Е(о2 /н2о) = 1, 23 - 0, 059·рН, В
В табл. 8. 1 представлены катодные реакции восстановления кислорода с указанием потенциала в зависимости от рН среды.
|
|
|
Талица 7. 1
Катодные реакции восстановления кислорода в зависимости от рН среды
| рН | Реакция на катоде |
| О2 + 4Н+ + 4е = 2Н2О (Е0= +1, 23 В) | |
| О2 + 2Н2О + 4е = 4ОН- (Е0= +0, 81 В) | |
| О2 + 2Н2О + 4е = 4ОН- (Е0= +0, 41 В) |
Таким образом, в насыщенной кислородом кислой среде подвергаться коррозии с кислородной деполяризацией могут металлы, стандартный электродный потенциал которых отрицательнее +1, 23 В, в нейтральной +0, 81В и щелочной – отрицательнее + 0, 41В.
Электрохимическая коррозия с кислородной деполяризацией протекает:
а) в атмосфере любого влажного газа;
б) в водных растворах солей, щелочей, морской и речной воде;
в) в почве и т. д.
Продуктами коррозии с кислородной деполяризацией являются оксиды, гидроксиды.
2) с водородной деполяризацией
Катодное восстановление водорода идет по реакции:
2Н+ + 2е = Н2
Потенциал водородного электрода зависит от рН среды по уравнению
Е(н+/н2) = - 0, 059 · рН, В,
согласно которому, в кислых, нейтральных и щелочных средах он составляет:
| рН=0 | рН=7 | рН=14 |
| Е0= 0, 0 В | Е0= -0, 41 В | Е0= -0, 82 В |
Коррозии с водородной деполяризацией в кислых средах будут подвергаться металлы, стандартный потенциал которых отрицательнее 0, 0 В (например, . Fe, Ni, Zn, Cd, Al), в нейтральной среде отрицательнее -0, 41В, в щелочной среде отрицательнее -0, 82 В.
Коррозия с водородной деполяризацией имеет место:
а) при большой концентрации [H+] в растворах;
б) в отсутствие в растворе кислорода и когда они не покрыты оксидными пленками. В этом случае водород вытесняется из воды.
Продуктами коррозии с водородной деполяризацией являются различные соли.
Из приведенных данных видно, что более активными в коррозионном отношении являются среды, содержащие кислород, так как потенциал кислородного электрода больше потенциала водородного электрода на 1, 23 В при любых значениях рН.
Возникновение катодных и анодных участков на поверхности металла может быть связано: с химической и геометрической неоднородностью поверхности; механическими деформациями; неоднородностью коррозионной среды; контактом с другими металлами и многими другими факторами.
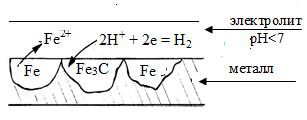
Химическая неоднородность поверхностиметалла может быть связана с наличием примесей других металлов, или включением оксидов, нитридов, карбидов и др. На рис 7. 2 и 7. 3 приведены схемы коррозии углеродистой стали для различных сред, в которых пассивными (катодными) участками являются зерна карбида железа:
|
|
|
а) кислая среда (рН< 7)
|
|
|


