 |
Аккумуляторы. Рис.6. 7. Схема элементарной ячейки кислотного аккумулятора
|
|
|
|
Аккумуляторы
Аккумуляторы относятся к перезаряжаемым источникам тока. В них внутренняя энергия обратимых окислительно-восстановительных реакций непосредственно преобразуется в энергию постоянного электрического тока. Одна из реакций, осуществляемая за счет внешнего источника постоянного тока, обеспечивает превращение электрической энергии в химическую и накопление последней. Этот процесс называется «зарядка» аккумулятора. Обратная реакция обеспечивает протекание электрического тока во внешней цепи за счет превращения накопленной химической энергии в электрическую. Данный процесс называется «разрядка» аккумулятора. После разрядки работоспособность аккумулятора восстанавливается вновь за счет процесса зарядки. На практике широкое применение получили кислотные и щелочные аккумуляторы.
Рассмотрим принцип работы на примере кислотного свинцового аккумулятора.
Ячейка представляет собой емкость, заполненную 30%-ным раствором серной кислоты, в которую помещены отрицательный (I) и положительный (II) электроды, разделенные специальной мембраной. Основой обоих электродов является металлическая решетка из сплава свинец-сурьма (Pb-Sb), обладающая хорошей механической прочностью. Активной массой отрицательного электрода (анода) является свинцовая губка (вспененный свинец с большой удельной поверхностью). Положительный электрод (катод) изготовлен из двуокиси свинца (PbO2). Мембрана предотвращает короткие замыкания между электродами.
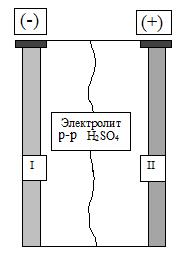
Рис. 6. 7. Схема элементарной ячейки кислотного аккумулятора
Схему аккумулятора при разрядке можно представить следующим образом:
|
|
|
(-) Pb | H2SO4 | PbO2 (+).
В процессе разряда аккумулятора на его отрицательном электроде протекает реакция окисления свинца, а на положительном – реакция восстановления двуокиси свинца:
(-) Pb - 2  = Pb2+ E0 = -0, 136 B
= Pb2+ E0 = -0, 136 B
(+) PbO2 + 4H+ + 2  = Pb2+ + 2H2O E0 = +1, 45B
= Pb2+ + 2H2O E0 = +1, 45B
В обоих процессах продуктом реакций является труднорастворимый сульфат свинца (PbSO4).
Токообразующая реакция представляет взаимодействие свинца с двуокисью свинца в кислой среде:
Pb + PbO2 + 4H+ + 2SO42- Û 2PbSO4↓ +2H2O
На практике часто о степени разряженности аккумулятора судят по плотности электролита. Чем меньше плотность, тем сильнее разряжено устройство.
При зарядке аккумуляторные клеммы подсоединяются к клеммам источника постоянного тока с соблюдением полярности. В процессе заряда все перечисленные реакции начинают протекать в обратном направлении. На отрицательных пластинах образуется свинец, а на положительных – двуокись свинца, т. е. нарабатывается исходная активная масса.
Среди множества щелочных аккумуляторов следует выделить железо-никелевые, никель-кадмиевые и серебряно-цинковые системы. В щелочных аккумуляторахэлектролитом является раствор щелочи. Например, в железо-никелевом аккумуляторе электролитом является концентрированный раствор КОН. Схема аккумулятора следующая:
( - ) Fe | КОН |NiOOH ( + ).
Заряд и разряд происходят в результате реакции:
Fe(OH)2 + 2Ni(OH)2 Û Fe + 2NiOOH + 2H2О,
что соответствует восстановлению Fe2+ до Fe0 и окислению Ni2+ до Ni3+
при заряде и обратным процессам при разряде.
Преимущество щелочных аккумуляторов, по сравнению со свинцовым кислотным аккумулятором, в том, что они имеют больший срок службы.
Одним из видов аккумуляторов являются аккумуляторы, в которых в качестве анодов используются высокоактивные щелочные металлы, а в качестве катодов – сложные оксидные системы. Особняком стоят литий-ионные аккумуляторы. В них реализованы все достоинства литиевых систем, но исключается возгорание при попадании воздуха или влаги.
|
|
|
|
|
|


