 |
Схема электролиза расплава. Электролиз расплава хлорида магния с угольными электродами. Законы Фарадея
|
|
|
|
Схема электролиза расплава
Для получения активных металлов, которые невозможно выделить из водных растворов их солей, используют электролиз их солевых расплавов. Технологически электролиз расплавов – довольно сложный процесс, требующий большого расхода энергии.
Реальные процессы на электродах и в электролите при электролизе расплавов несколько отличаются от приведенной далее упрощенной схемы.
Электролиз расплава хлорида магния с угольными электродами
Схема электролизера: (-) Сграфит| MgCl2(расплав)| Сграфит (+)
При высокой температуре кристаллическая решетка хлорида магния разрушается MgCl2→ Mg2+ + 2Cl-, поэтому в расплаве ионы Mg2+ и Cl- находятся в свободном состоянии. Под действием электрического поля катионы Mg2+ будут двигаться к катоду, анионы Cl- – к аноду:
(+) An: 2 Cl- - 2  = Cl2
= Cl2
(-)Kat: Mg2+ + = Mg0
Суммарная реакция электролиза:
Mg2+ + 2Cl- = Mg0 + Cl2 ИМУ
MgCl2 = Mg0 + Cl2 МУ
В процессе электролиза магний получают в жидком виде. Для исключения обратного процесса хлорирования магния, выделяющимся на аноде хлором, прикатодное и прианодное пространства разделяют диафрагмой.
Законы Фарадея
Так как прохождение электрического тока через электрохимическую систему связано с химическими превращениями, то между количеством прошедшего электричества и количеством прореагировавших веществ существует определенная связь. Эта связь установлена Фарадеем.
Первый закон Фарадея: Количества веществ, превращенных при электролизе, пропорциональны количеству электричества, прошедшего через электролит. Этот закон можно представить уравнением:
|
|
|
| m = kQ = kIt, | (6. 8) |
где m, г – масса вещества; k – электро-химический эквивалент; Q, Кл – количество электричества; I, А – сила тока; t, с – время, с.
Электрохимический эквивалент равен теоретической массе прореагировавшего или образовавшегося на электроде вещества при прохождении 1-го фарадея (F) электричества.
Второй закон Фарадея: При прохождении одного и того же количества электричества через различные электролиты количества веществ, подвергшихся превращению у электродов, пропорциональны их химическим эквивалентам (Э):
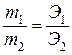 , ,
| (6. 9) |
Химический эквивалент определяется по формуле:
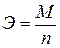 , ,
| (6. 10) |
где М (г/моль) – молярная масса вещества; n, моль-1 – число электронов в полуреакции.
Экспериментально установлено, что для выделения на электроде одного эквивалента вещества, необходимо затратить одно и то же количество электричества, равное ~96500 Кл. Оно получило название постоянной Фарадея F: F = 96500 Кл /моль или F = 26, 8 A·ч /моль.
На основании второго закона Фарадея можно записать:
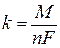 . .
| (6. 11) |
Объединяя выражения (7. 14) и (7. 17), получаем соотношение:
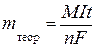 . .
| (6. 12) |
На практике вследствие протекания параллельных окислительно- восстановительных процессов на электродах образуется меньше вещества, чем соответствует прошедшему через раствор электричеству.
Для характеристики потерь электричества при электролизе введено понятие выход по току (Вт). Выходом по току называется выраженное в процентах отношение количества, фактически полученного продукта электролиза mфакт. к теоретически рассчитанному mтеор, соответствующему количеству прошедшего электричества:
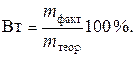
| (6. 13) |
Сочетая уравнения (6. 12) и (6. 13), получаем выражение для расчета фактической массы вещества, прореагировавшего на электродах:
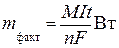 . .
| (6. 14) |
Если необходимо рассчитать объем образовавшегося в электродной реакции газа, то уравнение (6. 14) может быть преобразовано к виду:
|
|
|
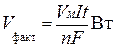 , ,
| (6. 15) |
где Vm (л/моль) – молярный объем – 22, 4 л/моль.
|
|
|


