 |
Примеры решения задач
|
|
|
|
Примеры решения задач
Пример 6. 1. Напишите катодный и анодный процессы и уравнение токообразующей реакции в свинцово-цинковом гальваническом элементе при Т = 298К, в котором [Zn2+]=0, 1моль/л, [Pb2+]=0, 01моль/л. Составьте схему гальванического элемента. Укажите направление движения электронов при замыкании цепи. Рассчитайте ЭДС.
Решение. Поскольку концентрации потенциалопределяющих ионов отличаются от 1 моль/л, рассчитаем значения электродных потенциалов цинка и свинца по уравнению Нернста для металлических электродов: ЕМеn+/Me= Е0Меn+/Me +  .
.
ЕZn2+/Zn=  ,
,
ЕPb2+/Pb=  .
.
Сравнивая потенциалы цинкового и свинцового электродов, определяем, что анодом является цинковый электрод с меньшим значением потенциала, а катодом – свинцовый электрод. Реакции, протекающие на электродах:
(-) А: Zn – 2 ē → Zn2+
(+) К: Pb2+ + 2 ē → Pb
Уравнение токообразующей реакции: Zn + Pb2+ → Zn2+ + Pb.
Схема гальванического элемента:
(-) Zn│ Zn2+(0, 1M)║ Pb2+(0, 01M)│ Pb (+).
При замыкании цепи, электроны во внешней цепи пойдут от отрицательно заряженного электрода к положительно заряженному электроду, т. е. – от цинка к свинцу.
Рассчитываем ЭДС гальванического элемента:
ЭДС= Екатода – Еанода = ЕPb2+/Pb - ЕZn2+/Zn  .
.
Пример 6. 2. Для гальванического элемента:
Pt│ Cr3+ (0, 1 моль/л), Cr2+(0, 01 моль/л)║ Н+(рН=2)│ Н2, Pt
написать уравнения электродных процессов, составить уравнение токообразующей реакции, указать полярность электродов. Определить направление движения электронов во внешней цепи. Рассчитать ЭДС.
Решение. Данный гальванический элемент составлен из окислительно-восстановительного и водородного электродов. Поскольку концентрации потенциалопределяющих ионов отличаются от 1 моль/л, рассчитаем значения электродных потенциалов.
|
|
|
Потенциал окислительно-восстановительного электрода определяем по уравнению Нернста:
ЕCr3+/Cr2+= Е0 Cr3+/Cr2+ 
ЕCr3+/Cr2+  .
.
Потенциал водородного электрода, в зависимости от рН, рассчитываем по уравнению Нернста:
-0, 059рН= -0, 059∙ 2= -0, 118В.
Определяем катод и анод. Поскольку окислительно-восстановительный электрод имеет меньший потенциал, то в гальваническом элементе он будет анодом (отрицательный полюс), а водородный электрод – катодом (положительный полюс). После замыкания цепи на первом электроде будет протекать процесс окисления, на втором – процесс восстановления:
 (-) А: Cr2+ - ē → Cr3+ ∙ 2
(-) А: Cr2+ - ē → Cr3+ ∙ 2
(+) К: 2 Н+ + 2 ē → Н2
Суммарная токообразующая реакция описывается уравнением:
2 Cr2+ + 2 Н+ → 2 Cr3+ + Н2
Электроны при замыкании внешней цепи будут двигаться от отрицательного полюса к положительному: от хромового окислительно-восстановительного электрода к водородному.
Рассчитываем ЭДС гальванического элемента:
ДЕ0 = Е0катода – E0анода = 
Пример 6. 3. Какие процессы протекают на электродах в концентрационном гальваническом элементе, с цинковыми электродами, если у одного из электродов концентрация ионов цинка (Zn2+) равна 1 моль/л, а у другого – 0, 0001 моль/л? Напишите схему ГЭ и рассчитайте ЭДС.
Решение. Концентрационный гальванический элемент состоит из одинаковых электродов, погруженных в растворы своих солей различной концентрации. Определим потенциалы обоих электродов. Так как концентрация ионов цинка у первого электрода равна 1 моль/л, то потенциал его будет равен стандартному потенциалу цинкового электрода: Е0Zn2+/Zn =-0, 763В.
Потенциал второго электрода рассчитаем по уравнению Нернста:
ЕZn2+/Zn=  .
.
Первый электрод с меньшим потенциалом является катодом, второй – анодом. Реакции, протекающие на электродах:
|
|
|
(+) К: Zn2+ + 2 ē → Zn
(-) А: Zn - 2 ē → Zn2+
Zn + Zn2+→ Zn + Zn2+ ˗ токообразующая реакция.
Схема гальванического элемента:
(-) Zn│ Zn2+(0, 0001 моль/л)║ Zn2+(1 моль/л)│ Zn (+)
Рассчитываем ЭДС гальванического элемента:
ДЕ0 = Е0катода – E0анода = 
Пример 6. 4. Составьте схему электролиза водного раствора хлорида никеля (NiCl2) с инертными электродами. Вычислите массу вещества и объем газа, выделившихся на электродах, если время электролиза составляет 50 мин, а сила тока 3 А. Какие вещества будут выделяться на электродах, если заменить инертный анод на марганцевый?
Решение. Предположим, что в качестве инертного анода и катода используются угольные электроды. Схема электролизера:
(-) Cграфит | NiCl2(раствор) | Cграфит (+).
1. В водном растворе хлорид никеля полностью диссоциирует на ионы: NiCl2 → Ni2+ + Cl-, таким образом, в электролите присутствуют три вида частиц, способных участвовать в электродных реакциях (ионы Ni2+, Cl- и молекулы воды Н2О). Графит является инертным электродом.
2. Возможные анодные реакции:
(+) An: 2 Cl- - 2  = Cl2 E0 = +1, 36 B
= Cl2 E0 = +1, 36 B
2 Н2О - = O2 + 4H+ E0 = +1, 23 B
Возможные катодные реакции:
(-)Kat: Ni2+ +2 = Ni0 E0 = -0, 25 B
2Н2О + 2= H2 + 2OH- E0 = -0, 82 B
3. На аноде в конкурирующих реакциях выделяются газы, которые сопровождаются высоким перенапряжением, особенно для кислорода.
С учетом этого, наименьший потенциал имеет первая реакция, в которой выделяется хлор.
На катоде наибольший потенциал у первой реакции, в которой выделяется никель.
4. Сложив выбранные уравнения, получим суммарную реакцию электролиза:
2 Cl- + Ni2+ = Cl2 + Ni0 ИМУ
NiCl2 = Cl2 + Ni МУ
Таким образом, при электролизе водного раствора хлорида никеля на аноде образуется молекулярный хлор, на катоде ̶ осаждается никель.
Масса никеля рассчитывается по первому закону Фарадея:
 г.
г.
Масса кислорода рассчитывается по второму закону Фарадея (7. 18): 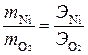 , откуда
, откуда  ,
,
где эквивалентные массы никеля и кислорода соответственно равны:
ЭNi  =29, 35г/моль, ЭО2=
=29, 35г/моль, ЭО2=  =8г/моль.
=8г/моль.
Таким образом,  г, или в литрах:
г, или в литрах:
 л.
л.
При замене угольного анода на марганцевый возможно его окисление. Таким образом, к двум конкурирующим реакциям на аноде добавляется реакция окисления марганца:
|
|
|
(+) An: 2 Cl- - 2  = Cl2 E0 = +1, 36 B
= Cl2 E0 = +1, 36 B
2 Н2О - = O2 + 4H+ E0 = +1, 23 B
Mn – 2е  = Mn2+ E0 = -1, 17 B
= Mn2+ E0 = -1, 17 B
Последняя реакция имеет меньший потенциал, поэтому при электролизе раствора NiCl2 марганцевый электрод будет окисляться, и в прианодном пространстве образуется хлорид марганца.
Суммарная реакция электролиза: NiCl2 + Mn = Ni + Mn Cl2.
|
|
|


