 |
Амперметричне (вольтамперометричне) титрування
|
|
|
|
Амперометричне титрування являє собою титриметричний метод аналізу, у якому для індикації точки еквівалентності використовують струм, що виникає в ланцюзі за рахунок розряду іонів, які беруть участь у титруванні (визначуваного компонента, надлишку титранту) або продуктів їx взаємодії. Амперометричне титрування являє собою модифікацію полярографічного методу аналізу, заснованого на пропорційності дифузійного граничного струму від концентрації речовини, що приймає участь в електродній реакції i що обумовлює зміну граничного дифузійного струму, яка i є аналітичним сигналом у розглянутому методі аналізу.
В амперметричному титруванні визначуваний іон титрується стандартним розчином, при цьому вимірюють значення після кожного додавання титранту. По витраті стандартного розчину титранту (перетинанню двох прямих) знаходять графічним методом, точку еквівалентності i розраховують масу визначуваної речовини або її масову частку, використовуючи знайомі для титриметрії розрахункові формули:
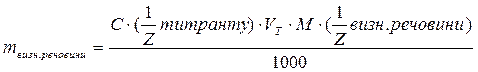 (г),
(г),
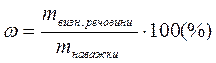 , або
, або

Рис. 2. 3 Графічне зображення зв'язку між полярограмами (вольтамперними кривими) 1 i кривими амперометричного титрування (2, 3)
Можливості амперометричного титрування значно ширші, ніж полярографічного аналізу. У полярографії електродну реакцію повинний давати визначуваний ioн. У той час як в амперометрії електрохімічно активними можуть бути не тільки визначуваний компонент, але i розчин, яким титрують, або продукт xiмiчнoї реакції, що виділяється. В амперметрії використовують реакції осадження, комплексоутворення і окисно-відновні реакції. Ширше i діапазон визначуваних концентрацій.
|
|
|
Так само як і в полярографії при амперметричному титруванні використовують мікро- і мікроелектроди. При анодній поляризації як мікроелектроди частіше застосовують Pt, рідше графіт, срібло, або золото. У випадку катодної поляризації – ртутно-крапельний або амальгамований електроди. Макроелектродом служить каломельний або хлор-срібний електрод.
Для виконання аналізу амперметричним методом необхідне виконання наступних двох основних умов:
1. У розчині кількісно, швидко і селективно повинна протікати хімічна реакція:


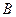

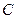
визначуваний титрант продукт
іон реакції
2. Один із компонентів (А, В або С) повинний бути електрохімічно активним. Тобто при напрузі, що накладається, іони (молекули) А, В або С повинні давати електродну реакцію. Вони повинні окислюватися, або відновлюватися на мікроелектроді.
Криві амперометричного титрування будують у координатах сила струму (I, мкА або ділінням гальванометра) – об’єм доданого титранту.
Розрізняють 4 основні форми кривих титрування, що залежать від електрохімічних властивостей реагуючих компонентів.
1. Електрохімічно активний визначуваний іон (А).

На початку титрування концентрація іону, що визначається, велика. Сила струму висока. Іноді вона більш 100 одиниць шкали гальванометра. При титруванні концентрація А зменшується. Сила струму стає меншою:
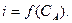
Після точки еквівалентності струм залишається постійним. Така форма спостерігається при визначенні, наприклад заліза (ІІ) ванадатом амонію. В аналізованому розчині перебігає хімічна реакція:
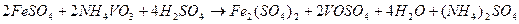 ,
,
або в іонному вигляді:
 .
.
Електродна реакція. Визначуваний компонент Fe2+ окиснюється на мікроаноді. Це мікропроцес. Втрати заліза (ІІ) практично не спостерігаються:
|
|
|
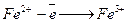
2. Електрохімічно активним при визначеній напрузі є титрант (В), надлишок якого з’являється тільки після точки еквівалентності. Тобто, поки титрант витрачається на реакцію струм ланцюга невеликий і постійний.
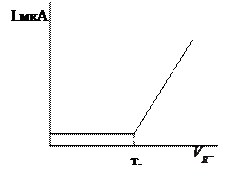
Після точки еквівалентності з появою надлишку розчину, яким титрують, фіксується збільшення струму.
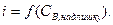
Як приклад можна навести титрування цинку (ІІ) органічним реагентом 8-меркаптанохіноліном (RSH).
Хімічна реакція в розчині:

Електрохімічний мікропроцес: окиснення 8-меркптахіноліну до дисульфіду на мікроаноді:

3. Якщо електрохімічне активні два компоненти А і В, тобто  і
і 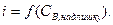 , то крива титрування виходе найбільш чіткої. Спочатку струм зменшується, а потім різко зростає. Розглянути форму кривої можна одержати у випадку свинцю (ІІ) хроматом калію.
, то крива титрування виходе найбільш чіткої. Спочатку струм зменшується, а потім різко зростає. Розглянути форму кривої можна одержати у випадку свинцю (ІІ) хроматом калію.

Хімічна реакція в розчині:

Електрохімічні реакції відновлення на мікроелектроді:
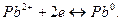
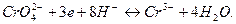
За рахунок пасивації електроду поблизу точки еквівалентності струм зменшується (залишковий), як тільки з’являється надлишок R-, пропорційно збільшенню СR, струм збільшується.
4. Електродну реакцію може давати і продукт хімічного процесу, що відбувається у розчині (речовина С). У цьому випадку за мірою додавання титр анту концентрація продукту збільшується. Росте і струм, що фіксується мікро гальванометром.

Після точки еквівалентності концентрація продукту реакції залишається постійною. Струм не змінюється.

Прикладом такої залежності може слугувати амперметричне визначення арсену (V) йодидом калію. Титрування виконують у сильно кислому середовищі.
Хімічна реакція, яка перебігає в розчині в процесі титрування:

Електродний мікропроцес, що відбувається на електроді:

|
|
|


