 |
Розділ 2. Електрохімічні методи аналізу
|
|
|
|
РОЗДІЛ 2. ЕЛЕКТРОХІМІЧНІ МЕТОДИ АНАЛІЗУ
2. 1. ПОТЕНЦІОМЕТРІЯ
Теоретичні основи методу
Потенціометричний метод аналізу заснований на вимірі електродних потенціалів оборотних гальванічних елементів і встановленні залежності між величиною електродного потенціалу та активністю (концентрацією) потенціал визначального компоненту в розчині. Використовуючи цю залежність можна визначити величину активності (концентрації) потенціал визначальних компонентів, простежити за зміною активності (концентрації) реагуючих речовин у розчині, а також визначити ряд фізико-хімічних характеристик досліджуваних рівноважних систем. Залежність між величиною потенціалу та активностями компонентів в розчині, яки визначають, математично відображає рівняння Нернста.
За призначенням потенціометричний метод аналізу може бути класифікований як пряма потенціометрія і потенціометричне титрування.
Пряма потенціометрія ґрунтується на безпосередньому використанні для практичних цілей вимірюваної величини рівноважного потенціалу електрода. У цьому випадку потенціал індикаторного електрода
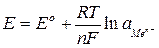
або
 ,
,
 і
і  стандартні потенціали, виміряні за певних умов
стандартні потенціали, виміряні за певних умов
(Т = 298 К, а = 1, р = 1 атм);  кількість електронів, які беруть участь в електродному процесі (заряд іонів); R – універсальна газова стала (Дж/моль*К); F – число Фарадея (кл/моль); Т – температура (К);
кількість електронів, які беруть участь в електродному процесі (заряд іонів); R – універсальна газова стала (Дж/моль*К); F – число Фарадея (кл/моль); Т – температура (К);  та
та  активність у розчині катіонів або аніонів.
активність у розчині катіонів або аніонів.
Активність зв’язана з концентрацією іонів відомим рівнянням:

Предметом вивчення в прямій потенціометрії можуть бути лише оборотні редокс системи. До прямої потенціометрії відносяться:
|
|
|
1. рН – метрія – крім найбільш важливого застосування, а саме визначення рН, вона широко використовується для вивчення констант дисоціації протолітів, стійкості комплексних сполук, утворених лігандами з протеолітичними властивостями;
2. Іонометрія - визначення активності іонів за допомогою іон селективних електродів. Іонометрія активно розвивається в зв’язку з застосуванням мембранних іон селективних електродів;
3. Редоксіметрія – метод вивчення окисно-відновних систем і реакцій. За допомогою прямої потенціометрії здійснюється визначення стандартних потенціалів і констант рівноваги редокс реакцій.
4. Пряма потенціометрія з металічними електродами застосовується при вивченні хімічних реакцій осадження і комплексоутворення. Велика кількість величин ДР малорозчинних і констант стійкості комплексних сполук визначені за допомогою цього методу.
Методами прямої потенціометрії встановлюють коефіцієнти активності, стехіометричні коефіцієнти хімічних реакцій, число електронів, що беруть участь у реакції.
Потенціал індикаторного електрода вимірюють відносно електрода порівняння, потенціал якого є відомим та постійним за даних умов:
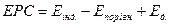 ,
,
де ЕРС – електрорушійна сила гальванічного елемента, Еінд. та Епорівн. – потенціали електродів індикаторного та порівняння відповідно, а Ед. – дифузійний потенціал, або рідинний потенціал, що виникає на границі між розчинами двох різних електролітів або розчинів одного електроліту різної концентрації.
Виникнення дифузійного потенціалу обумовлене нерівномірним розподілом катіонів і аніонів уздовж межі розподілених розчинів внаслідок розходження у швидкостях дифузії іонів через поверхню розділу. На практиці дифузійний потенціал елімінують за допомогою сольового містка, заповненого концентрованим розчином електроліту з однаковою рухлівістю катіона та аніона (KCl, KNO3, NaCl). Сольовий місток поміщають між розчинами, заміняючи таким чином межі розподілу та істотно зменшуючи дифузійний потенціал.
|
|
|
Індикаторним називають електрод, потенціал якого залежить від активності (концентрації) іона, що визначається, відповідно до рівняння Нернста. Він повинний задовольняти таким вимогам:
– Потенціал повинний встановлюватися досить швидко;
– Бути добре відтворюваним:
– Хімічно стійким;
– Бути оборотним при дослідженні потенціалу металічного електрода і деяких інших систем.
У залежності від механізму процесів, що відбуваються (електронна, електронно-іонна, або іонна рівновага), розрізняють три типи електродів:
– Окисно-відновні (індиферентні) електроди (платина, золото, срібло, іридій, графіт), що знаходяться в контакті з якось редокс системою. Потенціал таких електродів залежить від відношення активностей (концентрацій) окисної і відновної форм;
– Металічні (мідь, срібло, ртуть, кадмій, цинк) електроди першого роду. Число таких електродів обмежене, тому що з багатьма металами (хром, кобальт та ін.. ) не вдається одержати відтворювані дані.
– Мембранні (іонселективні) електроди, коли використовується не електрохімічна реакція з перенесенням електронів, а різниця потенціалів, що виникає на межі розподілу фаз, і рівновага обміну іонів між мембраною і розчином. Найбільш широко застосовані скляний, фторидний, нітратний, сульфідний електроди.
Як електроди порівняння найчастіше використовують стандартний водневий (СВЕ), насичений каломельний (нас. КЕ), хлоридсрібний. Потенціал електрода порівняння повинен залишатися сталим незалежно від тих процесів, які проходять у аналізованому розчині.
Значення рН розчинів вимірюють за допомогою водневого, хінгідронного або скляного електродів.
У розчині з невідомим рН потенціал водневого електрода

де 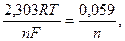 якщо t = 25 0C. За міжнародною згодою прийнято вважати, що потенціал стандартного водневого електрода (СВЕ) при будь яких температурах дорівнює нулю і відносно нього виражати потенціали інших окисно-відновних систем для зручного порівняння величин. Отже:
якщо t = 25 0C. За міжнародною згодою прийнято вважати, що потенціал стандартного водневого електрода (СВЕ) при будь яких температурах дорівнює нулю і відносно нього виражати потенціали інших окисно-відновних систем для зручного порівняння величин. Отже:

Водневий електрод мало зручний у роботі і у якості індикаторного, і у якості електрода порівняння, крім того він не може бути використаний у присутності інших окисників та відновників.
|
|
|
Потенціал хінгідронного електрода

Якщо концентрація хінону та гідрохінону однакові, то

або

Залежно від рН потенціал скляного електрода

де const – стала, яка залежить від сорту скла та його іонообмінних властивостей.
Інший варіант потенціометрії – потенціометричне титрування.
Потенціометричне титрування полягає в кількісному визначенні вмісту речовини, що аналізується, титруванням з потенціометричною індикацією кінцевої точки титрування (к. т. т. ).
Досліджуваний розчин титрують стандартним розчином сполуки, що взаємодіє з визначаємим компонентом. Після кожного додавання титранту записують значення ЕРС. В області к. т. т. має місце заміна однієї електрохімічної (потенціалвизначальної) реакції на іншу, що супроводжується стрибком титрування. Будують криву потенціометричного титрування. Графічно знаходять точку еквівалентності (див. мал. ) і виконують розрахунки:



У порівнянні з титриметрією (візуальною індикацією к. т. т. ) потенціометричне титрування має такі переваги:
1. Виключаються суб'єктивні помилки, які можливі при візуальній фіксації к. т. т.;
2. Потенціометричний метод більш чутливий, має низьку межу визначення концентрацій;
3. З потенціометричною фіксацією к. т. т. можливе титрування змужнілих і кольорових розчинів, коли неможливе використання кольорових індикаторів;
4. Потенціометричним методом можливе проведення диференційного (послідовного) титрування компонентів розчину в їх суміші;
5. Потенціометричне титрування легко піддається автоматизації процесу титрування.
При проведенні потенціометричному титруванні, як і при титриметрії, можуть бути використані всі чотири типи хімічних реакцій: нейтралізації, окиснення-відновлення, осадження та комплексоутворення.
Вимоги до реакцій такі:
– досить велика швидкість перебігу;
– кількісне протікання реакцій, тобто велика константа рівноваги;
|
|
|
– стехіометричність досліджуваної реакції, тобто відсутність перебігу побічних реакцій разом з основною.
|
|
|


