 |
Приклади розв’язування типових задач
|
|
|
|
Приклади розв’язування типових задач
Приклад 1. Для гравіметричного визначення міді наважку сплаву масою
0, 6578 г розчинили та через одержаний розчин упродовж 20 хв. пропускали струм силою 0, 20 А, внаслідок чого на катоді кількісно виділилася мідь. Вихід за струмом становив 80 %. Визначити масову частку (%) міді в сплаві.
Розв’язування
У процесі електролізу розчину на катоді відбувається процес:
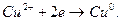
За законом Фарадея обчислюють масу міді, яка в процесі електролізу повинна виділятися на катоді. Час електролізу виражають у секундах:

Враховуючи, що вихід за струмом становить 80 %, реально на катоді виділятиметься значна менша кількість міді, а саме:

Масова частка купруму у сплаві становить
 або
або 
Відповідь: 9, 6 %.
Приклад 2. При якому значенні потенціалу (відносно насиченого каломельного електрода) концентрація нікелю зменшиться до 10-5 моль/л у розчині:
а) розчині  у хлоратній кислоті;
у хлоратній кислоті;
б) розчині  з рівноважною концентрацією
з рівноважною концентрацією  , яка дорівнює 0, 0100 моль/л:
, яка дорівнює 0, 0100 моль/л:


в) розчині  з рівноважною концентрацією
з рівноважною концентрацією 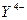 , яка дорівнює 0, 0100 моль/л (
, яка дорівнює 0, 0100 моль/л ( 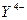 - аніон ЕДТА)?
- аніон ЕДТА)?
Розв’язування.
а) 




б) 
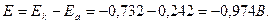
в) 


 (з довідника)
(з довідника)



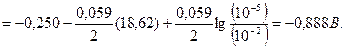

Відповідь: а) – 0, 640 В; б) – 0, 974 В; в) – 1, 13 В.
Приклад 3. Обчислити напругу розкладу 0, 1 М розчину CuSO4, рН якого 1, 0. Обидва електроди платинові, перенапруга виділення кисню в цих умовах  . Сила струму під час проходження електролізу становить 0, 25 А, опір розчину R = 5, 0 Ом. Яка буде напруга на момент повного виділення купруму?
. Сила струму під час проходження електролізу становить 0, 25 А, опір розчину R = 5, 0 Ом. Яка буде напруга на момент повного виділення купруму?
Розв’язування
На електродах проходять такі процеси:
Катод: 
 ;
;
|
|
|
Анод: 
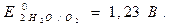 (з довідника).
(з довідника).
Напругу розкладу обчислюють за рівнянням:

У це рівняння підставляють усі необхідні величини; потенціал катода обчислюють за рівнянням Нернста, де концентрація С(Cu2+) = 0, 1 M;

Щоб знайти напругу, під час якої досягається повне виділення купруму, проводять аналогічне обчислення, підставляючи концентрацію
С(Cu2+) = 10-6 моль/л:
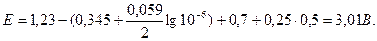
Відповідь: 1) 2, 86 В; 2) 3, 01 В.
Задачі для самостійного розв’язування
1. Обчислити протягом якого часу при електролізі розчину СuCl2 виділиться
0, 125 г купруму, якщо сила струму 4, 0 А. Скільки у цьому випадку виділиться мл Cl2 на аноді?
2. Для одержання амальгами кадмію (розчин кадмію у ртуті) методом електролізу через розчин солі кадмію пропускають струм силою 0, 5 А протягом 4 хв. Обчислити вміст кадмію в амальгамі (%), якщо для її одержання взяли ртутний катод масою 15 г.
3. Визначити, сіль якого тривалентного металу була у розчині, якщо після електролізу, який проводили при силі струму 3 А протягом 35 хв, на катоді виділилося 0, 5815 г металу?
4. У розчині містяться 1 М H2SO4, 0, 01 M CuSO4 і 0, 01 M Ag2SO4. Чи можна електролітичним методом розділити ці іони, якщо густина струму на платинових електродах 0, 01 А / см2, а перенапруга виділення кисню в цих умовах  = 0, 47 B?
= 0, 47 B?
5. У розчині містяться іони I- і Br-, з концентраціями 0, 040 моль/л, які в процесі електролізу виділяються на срібному аноді як нерозчині галогеніди аргентуму згідно з рівнянням:
Ag+(тв) + X- - e = AgX(тв), де Х-: I- або Br.
Чи можна кількісно розділити ці іони, змінюючи потенціал срібного анода?
6. Катодне відділення комірки для внутрішнього електролізу містить 50 мл 0, 3000 моль/л розчину Cu2+ та мідний електрод. Цинковий електрод, що занурений в 250 мл розчину з концентрацією [Zn2+] = 3*10-4 моль/л, є анодом. Опір комірки 8, 5 Ом. Визначити: а) початковий потенціал комірки до проходження струму; б) початкову силу струму, який виникає у випадку замикання електродів накоротко провідником; в) потенціал у випадку зменшення концентрації [Cu2+] до 1, 00*10-5 моль/л.
|
|
|
7. Під час електроосадження міді концентрація [Cu2+] біля поверхні електрода дорівнює 1, 0*10-5 М, а в об’ємі розчину -1, 0*10-3 М. Обчислити концентраційну перенапругу.
8. Вісмут виділяють на катоді з розчину, який містить 0, 1500 моль/л ВіО+ та 0, 6000 М HClO4. На плативому аноді площиною 20 см2 перебігає реакція окиснення води. Комірка має опір 1, 3 Ом. Обчислити перенапругу виділення O2.
9. При якій напрузі, прикладеній до електродів, з водного розчину CuSO4*5H2O на катоді почне виділятися купрум, якщо потенціал анода, на якому виділяється O2, Ea = +1, 23 В, сила струму 1, 0 А, опір комірки 0, 5 Ом, а перенапруга для кисню -0, 85. Концентрація CuSO4 у розчині 1) 0, 100 М; 2) 0, 0100 М; 3) 0, 0500 М; 4) 0, 200 М.
10. Концентрація іонів у розчині солі: 1) Zn2+ 0, 10 моль/л, 2) Cu2+
0, 00500 моль/л; 3) Cо2+ 0, 0200 моль/л. У розчин занурені платиновий катод та 0, 1 М каломельний електрод як анод. Яку напругу треба прикласти до електродів, щоб на катоді почав електролітично осаджуватись метал? Опір комірки 0, 5 Ом, а сила струму, який пропускають через розчин – 0, 50 А, потенціал 0, 1 М каломельного електрода 0, 334 В.
11. Яке значення потенціалу катода зумовить початок осадження ртуті з
0, 0030 М розчину Hg(NO3)2 та при якому потенціалі концентрація іонів Hg2+ понизиться до 1*10-6 моль/л?
12. Чи можна, змінюючи потенціал катода, розділити в розчині 1) 0, 010 М іони Рb2+ і Cu2+; 2) 0, 10 М іони Ni2+ і Cu2+; 3) 0, 010 М Cu2+ і 0, 10 М Ag+, вважаючи критерієм розділення залишкову концентрацію іона, який не виділився під час електролізу, рівну 1*10-6 моль/л?
13. Чи можна розділити та визначити цинк, купрум та вісмут y розчині, який містить 0, 0650 моль/л BiO+, 0, 3300 моль/л Cu2+, 0, 1400 моль/л Zn2+ та 1, 05 M HClO4.
А. Вважаючи критерієм кількісного виділення металу зменшення концентрації його іона в розчині до 1, 00*10-6 М, визначити, чи можливе розділення цих елементів у випадку контрольованого потенціалу катода;
Б. Якщо розділення можливе, обчислити інтервал ( відносно НКЕ ), в якому слід підтримувати значення потенціалу катода;
В. При якому значенні потенціалу потрібно проводити кількісне осадження другого елемента після видалення першого?
|
|
|


