 |
Список літератури. Приклади розв’язування типових задач. Задачі для самостійного розв'язування
|
|
|
|
СПИСОК ЛІТЕРАТУРИ
1. Супрунович В. І., Плаксієнко І. Л., Шевченко Ю. І. Електрохімічні методи аналізу. Дніпропетровськ, УДХТУ, 2006. – 413 с.
2. Бонд А. М. Полярографические методы в аналитической химии. М.: «Химия», 1983. 328 с.
3. Васильев В. П. Аналитическая химия. – М.: Высш. шк., 1989. – Кн. 1. – 320 с. – Кн. 2. – 384с.
4. Виноградова Е. Н., Галлай З. А., Финогенова З. М. Методы полярографического и амперометрического титрования. М.: МГУ, 1960. 280 с.
5. Гейровский Я., Кута Я. Основы полярографии. М.: Мир, 1965. 559 с.
6. Дамаскин Б. Б., Петрий О. А. Введение в электрохимическую кинетику. М.: «Высшая школа», 1975. 416 с.
7. Крюкова Т. А., Синякова С. И., Арефьева Т. В. Полярографический анализ. М.: Госхимиздат, 1952. –772 с.
8. Ляликов Ю. С. Физико-химические методы анализа. М.: Химия, 1974. – 537 с.
9. Сонгина О. А., Захаров В. А. Амперометрическое титрование. М.: Химия, 1979. – 304 с.
10. Методичні вказівки до лабораторного практикуму з курсу “Аналітична хімія та інструментальні методи аналізу” (Амперометричне титрування) для студентів ІІІ курсів усіх спеціальностей напрямків “Хімічна технологія та інженерія”, “Харчова технологія та інженерія”, “Біотехнологія”, “Фармація” денних та заочних форм навчання / Укл.: В. І. Супрунович, Н. Г. Федорова. – Дніпропетровськ: УДХТУ, 2005. – 57 с.
Приклади розв’язування типових задач
Приклад 1. Визначити величину граничного дифузійного струму у розчині солі цинку, якщо її концентрація  моль/л, коефіцієнт дифузії
моль/л, коефіцієнт дифузії  см2/сек, маса ртуті, що витікає за секунду – 3 мг/с, період капання – 4 с.
см2/сек, маса ртуті, що витікає за секунду – 3 мг/с, період капання – 4 с.
Розв'язування
Величину граничного дифузійного струму обчисляють за рівнянням Ільковича, в яке концентрацію солі цинку підставляють у ммоль/л:
|
|
|
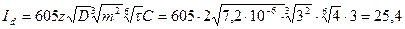 мкА.
мкА.
Відповідь: 25, 4 мкА.
Приклад 2. Визначити концентрацію іонів кадмію в розчині, якщо під час аналізу методом добавок 15 мл розчину, який містить іони кадмію, висота полярографічної хвилі становила 20, 5 мм, а після додавання 20 мл 0, 053 М стандартного розчину кадмій хлориду висота хвилі збільшилася до 24, 3 мм.
Розв'язування
Використовуємо рівняння:

 моль-екв/л
моль-екв/л
Відповідь: 0, 02 моль-екв/л
Приклад 3. У процесі амперометричного титрування ацетальдегіду (АА) 2, 4 – дінітрофенілгідразоном (ДНФГ) при потенціалі відносно донної ртуті – 1, 4 В одержали такі дані:
| V(ДНФГ) | 0, 2 | 0, 25 | 0, 35 | 0, 45 | 0, 53 | 0, 61 | 0, 69 | 0, 9 |
| I, мкА |
Обчислити масу ацетальдегіду у розчині, якщо титр ДНФГ за АА дорівнює  г/мл.
г/мл.
Розв'язування
З графіка, побудованого в координатах I – V, видно, що точка еквівалентності відповідає об’єму 0, 55 мл 2, 4 – дінітрофенілгідразину. Враховуючи, що

розраховуємо масу ацетальдегіду:
 г.
г.
Відповідь:  г.
г.
Задачі для самостійного розв'язування
1. Розрахувати характеристику капіляра для потенціалу – 0, 6 В відносно донної ртуті, якщо маса 20 краплин ртуті, що витекла з капіляра за 38 с, становить 0, 2518 г.
2. Визначити величину граничного дифузійного струму Tl (I) на фоні 0, 1000 М розчину калій нітрату, якщо С = 5, 0*10-4 М, D =1, 8*10-5 см2 *с-1, m = 5, 2 мг/с,
τ = 2, 3 c.
3. Визначити концентрацію іонів Cd2+ у розчині, якщо D = 7, 2*10-6 см2 *с-1,
m = 2, 0 мг/с, t = 4, 4 c, а сила струму 10 мкА.
4. У процесі полярографування стандартного 5*10-7 М розчину CdCl2 одержали полярографічну хвилю заввишки 4, 00 мм. Наважку зразка, що містив кадмій, масою 2, 500 г розчинили в кислоті та розвели водою до 50, 00 мл. Після полярографування одержали хвилю заввишки 6, 00 мм. Визначити вміст кадмію у зразку.
5. Визначити вміст кобальту у препараті. Для цього зразок масою 2, 500 г розчиняють, додають НCl та желатину і доводять до мітки в колбі ємністю
100 мл. Для полярографування відбирають 50, 00 мл розчину і одержують дифузійний струм 1, 05 мкА. Для цього розчину 5, 00 мл стандартного розчину, що містив 1, 00 * 10-2 М розчину солі кобальту та одержують дифузійні струми 3, 80 мкА. Знайти вміст кобальту в препараті.
|
|
|
6. У процесі полярографування насиченого розчину PbBr2 з амонійно-аміачним фоном одержали висоту хвилі 26 мм. Висота хвилі 0, 01 М стандартного розчину солі плюмбуму – 20 мм. Знайти константу розчинності PbBr2.
7. Під час полярографування стандартних розчинів Pb (II ) одержали такі дані:
СPb*106 г/мл 0, 50 1, 00 1, 50 2, 00
hcт, мм 4, 0 8, 0 12, 0 16, 0
Наважку алюмінієвого сплаву масою m (г) розчинили і розчин розбавили до 50, 00 мл. Висота полярографічної хвилі свинцю в одержаному розчині hх. Визначити масову частку (%) свинцю в аналізованих зразках за такими даними:
Варіант 1 2 3
m (г) 2, 500 5, 134 5, 300
h, мм 6, 0 9, 0 11, 0
8. Зразок сталі масою 0, 5000 г розчинили і розчин перенесли в мірну колбу місткістю 100 мл. Об’єм розчину довели до мітки дистильованою водою. В електролізер помістили 25 мл цього розчину та на фоні натрій ацетату здійснили амперметричне титрування (Е = - 1, 7 В ) іонів Ni2+ розчином диметилгліоксимом (ДМГ) концентрацією Т (ДМГ/Ni2+) = 2 мг/мл. Визначити масову частку ( %) нікелю у сталі, якщо під час титрування одержали такі дані, враховуючи, що 1 моль нікелю реагує з двома молями ДМГ:
V, мл 0, 10 0, 15 0, 20 0, 30 0, 40 0, 50
I, мkA 37, 0 28, 0 20, 5 18, 0 30 41, 5
9. Визначити концентрацію Cu2+ (мг/мл) в розчині, якщо під час амперметричного титрування 10, 00 мл досліджуваного розчину розчином K4[Fe(CN)6]з T[K4[Fe(CN)6]/Cu = 0, 002240 г/мл одержані такі значення для
Id (мкА):
| V, мл | Варіант | ||||||||
| 0, 0 0, 2 0, 4 0, 5 1, 0 1, 5 2, 0 2, 5 3, 0 | |||||||||
10. Визначити титр розчину іонів Сd2+, якщо під час амперметричного титрування 10, 0 мл цього розчину калій сульфату з молярною концентрацією еквівалента 0, 06117 моль/л ( Е = 1, 0 В ) одержали такі дані:
|
|
|
V, мл 0 0, 5 1, 0 1, 5 2, 0 2, 5
I, мkA 260 198 137 75 43 42.
|
|
|


