 |
Задачі для самостійного розв'язування
|
|
|
|
1. Обчислити потенціал срібного електрода, зануреного у водний розчин, який містить 13, 40 г AgNO3 в 500, 0 мл розчину, відносно: 1) водневого; 2) 0, 1 М каломельного електрода Е0, 1 КЕ =0, 334 В.
2. Різниця потенціалів між водневим та насиченим каломельним електродами
(ЕНКЕ =0, 334 В), зануреними в розчин кислоти, становить 0, 435 В при 25 0С. Визначити рН розчину.
3. ЕРС гальванічного елемента Ag/AgNO3 //0, 1 KCl, Hg2Cl2//Hg при 18 0С має величину 0, 35 В, Е0, 1 КЕ =0, 334 В. Визначити концентрацію аргентум нітрату в розчині.
4. Обчислити потенціал Hg2Cl2 / 2Hg, 2Cl- - електрода у розчині, який містить 0, 0500М Hg(NO3)2 та 1, 0 М NaCl, на підставі стандартного потенціалу напівреакції
 .
.
5. Обчислити стандартний потенціал напівреакції, виходячи із стандартного потенціалу іншої напівреакції:
а) 
б) 
в) 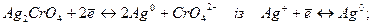
г) 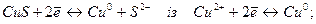
д) 
е) 
ж) 
з) 
к) 
л) 
6. Аналізуємий розчин НCl розвели водою в мірній колбі об’ємом 100, 00 мл і аліквоту 20, 00 мл потенціометрично відтитрували 0, 1000 М розчином NaОН. Побудувати криві титрування в координатах рН-V, DрН/DV - V та обчислити вміст НCl в розчині (мг) за такими даними:
Варіант 1
| VNaОН, мл | 1, 50 | 1, 80 | 1, 90 | 1, 95 | 1, 98 | 2, 00 | 2, 02 | 2, 05 | 2, 10 |
| рН | 2, 64 | 3, 05 | 3, 36 | 3, 64 | 4, 05 | 6, 98 | 9, 95 | 10, 53 | 10, 65 |
Варіант 2
| VNaОН, мл | 1, 30 | 1, 50 | 1, 60 | 1, 65 | 1, 68 | 1, 70 | 1, 72 | 1, 74 | 1, 80 |
| рН | 1, 78 | 3, 03 | 3, 34 | 3, 64 | 4, 03 | 6, 98 | 9, 96 | 10, 36 | 10, 66 |
7. Суміш хлоридної та боратної кислоти послідовно потенціометрично відтитровують 0, 1000 М розчином NaОН: спочатку відтитрували НCl (використали об’єм титранту V1), потім додали до розчину гліцерин та відтитрували Н3ВО3 за першим ступенем (використали сумарний об’єм титранту V2).
Побудувати криві титрування в координатах рН-V і DрН/DV - V та визначити об’єми V1, V2 та концентрації НCl і Н3ВО3 (г/л), якщо для аналізу було взято 20, 00мл суміші кислот і під час титрування одержали такі дані:
|
|
|
Варіант 1
| VNaОН, мл | 0, 00 | 0, 20 | 0, 30 | 0, 40 | 0, 46 | 0, 50 | 0, 55 | 0, 60 |
| рН | 2, 60 | 2, 84 | 3, 02 | 3, 40 | 3, 95 | 5, 58 | 7, 03 | 7, 38 |
додали гліцерин:
| VNaОН, мл | 0, 80 | 1, 00 | 1, 20 | 1, 40 | 1, 45 | 1, 50 | 1, 55 | 1, 60 | 1, 7 0 |
| рН | 5, 95 | 6, 25 | 6, 55 | 7, 04 | 7, 28 | 7, 73 | 8, 55 | 9, 10 | 9, 55 |
Варіант 2
| VNaОН, мл | 0, 00 | 0, 40 | 0, 60 | 0, 80 | 1, 00 | 1, 05 | 1, 10 | 1, 20 |
| рН | 2, 45 | 2, 61 | 2, 72 | 2, 85 | 3, 42 | 5, 82 | 6, 98 | 7, 32 |
додали гліцерин:
| VNaОН, мл | 1, 40 | 1, 60 | 1, 80 | 2, 00 | 2, 10 | 2, 15 | 2, 20 | 2, 25 | 2, 40 |
| рН | 5, 88 | 6, 26 | 6, 70 | 7, 28 | 7, 67 | 8, 10 | 9, 03 | 9, 75 | 10, 28 |
8. Наважку руди масою 0, 0800 г розчинили, уран перевели в уран (ІV) і потенціометрично відтитрували 0, 0500 М розчином КМnО4 (fекв=1/5):

Побудувати криві потенціометричного титрування в координатах Е-V і DЕ/DV - V та розрахувати масову частку урану (%) в руді за такими даними:
| VКМnО4, мл | 2, 00 | 10, 00 | 16, 00 | 17, 80 | 18, 00 | 18, 20 | 20, 00 |
| Е, мВ |
9. Наважку зразка масою 2, 0400 г розчинили і Тl(І) потенціометрично відтитрували 0, 0100 н розчином КВrО3 (fекв=1/6) в солянокислому середовищі:

Побудувати криві потенціометричного титрування в координатах Е-V, DЕ/DV - V і розрахувати масову частку талію (%) у сплаві за такими даними:
| VКВrО3, мл | 2, 00 | 10, 00 | 17, 00 | 18, 30 | 19, 00 | 19, 20 | 21, 00 |
| Е, мВ |
10. Наважку сталі масою 2, 000 г розчинили в нітратній кислоті та після відповідної обробки ванадій потенціометрично відтитрували 0, 1000 М розчином FeSO4 :

Побудувати криві потенціометричного титрування в координатах Е-V, DЕ/DV - V і розрахувати масову частку ванадію (%) у сплаві за такими даними:
| VFeSO4, мл | 2, 00 | 12, 00 | 19, 00 | 20, 80 | 21, 00 | 21, 20 | 23, 00 |
| Е, мВ |
11. Наважку установчої речовини масою m, г розчинили у мірній колбі місткістю 50, 00 мл і довели розчин до мітки льодяною ацетатною кислотою. Під час потенціометричного титрування 5, 00 мл одержаного розчину хлоратною кислотою в безводній ацетатній кислоті одержали такі результати: НСlO4
|
|
|
Варіант 1
| VНСlO4, мл | 1, 20 | 1, 40 | 1, 60 | 1, 80 | 2, 00 | 2, 20 | 2, 40 | 2, 60 |
| Е, мВ |
(калію гідрофталат КНС8Н4О4, т=0, 3996 г титрується до Н2С8Н4О4)
Варіант 2
| VНСlO4, мл | 1, 20 | 1, 40 | 1, 60 | 1, 80 | 2, 00 | 2, 20 | 2, 40 | 2, 60 | 2, 80 |
| Е, мВ |
(дифенілгуанідін С13Н13N6, т=0, 4003 г титрується за однією точкою еквівал-сті)
Варіант 3
| VНСlO4, мл | 3, 60 | 3, 80 | 4, 00 | 4, 20 | 4, 40 | 4, 60 | 4, 80 | 5, 00 | 5, 20 |
| Е, мВ |
(натрію карбонат Na2CO3, т=0, 2500 г титрується до NaНCO3 )
Побудувати криві потенціометричного титрування в координатах Е-V, DЕ/DV - V і розрахувати молярну концентрацію еквівалента розчину хлоратної кислоти за 1) калій гідрофталатом; 2) дифенілгідразином; 3) натрій карбонатом.
12. Обчислити потенціал платинового електрода в розчині FeSO4, відтитрованого розчином K2Cr2O7 на: а) 50%; б) 90%; в) 99%; г)100%; д) 100, 1%.
13. Обчислити потенціал срібного електрода відносно нормального хлоридсрібного в 1× 10-2М розчині KI, відтитрованому 1× 10-2М розчином AgNO3 на:
а) 50%; б) 90%; в) 99, 9%; г)100%; д) 100, 1%.
14. Обчислити потенціал водневого електрода в 0, 1000 М розчині НСООН, відтитрованому 0, 0100 М розчином NaОН на: а) 10%; б) 50%; в) 90%; г)100%; д) 100, 1%.
15. Обчислити потенціал в точці еквівалентності для кожного з наведених нижче випадків потенціометричного титрування. В усіх випадках вважати, що електрод порівняння насичений каломельний, а всі вихідні молярні концентрації еквівалентів в розчинах реагенту та речовини, яку титрують, дорівнюють
0, 01000 М.
А. Титрування С2О42- стандартним розчином Pb(NO3)2 з використанням свинцевого індикаторного електрода.
Б. Титрування Ті3+ розчином МnО4- з використанням платинового індикаторного електрода.
В. Титрування AsO43- стандартним розчином AgNO3 з використанням срібного індикаторного електрода.
|
|
|
|
|
|


