 |
Список літератури. Приклади розв’язування типових задач
|
|
|
|
СПИСОК ЛІТЕРАТУРИ
1. Супрунович В. І., Плаксієнко І. Л., Шевченко Ю. І. Електрохімічні методи аналізу. Дніпропетровськ, УДХТУ, 2006. – 413 с.
2. Антропов Л. И. Теоретическая электрохимия. М.: «Высшая школа», 1984. –519 с.
3. Корыта И., Дворжак И., Богачкова В. Электрохимия. М.: Мир, 1977. –472 с.
4. Корыта И., Шулик К. Ионселективные электроды. М.: Мир, 1989. 360 с.
5. Ляликов Ю. С. Физико-химические методы анализа. М.: Химия, 1974. –537 с.
6. Методические указания к лабораторному практикуму по физико-химическим методам анализа (потенциометрический и фотометрический методы). /Сост.: Сухоручкина А. С., Павличенко В. А. - Днепропетровск: ДХТИ, 1987. –44 с.
7. Методические указания к лабораторному практикуму по физико-химическим методам анализа для студентов III-V курсов технологических специальностей (потенциометрический метод). /Сост.: Супрунович В. И., Плаксиенко И. Л. - Днепропетровск: ДХТИ, 1994. – 27 с.
Приклади розв’язування типових задач
Приклад 1. Обчислити потенціал мідного електрода, зануреного у розчин купрум нітрату, відносно насиченого хлоридсрібного електрода, якщо в 150 см3 розчину міститься 24, 22 г Cu(NO3)2× 3H2O.
Розв'язування
Cтандартний потенціал пари Cu2+/Cu дорівнює 0, 3450 В. Потенціал насиченого хлорид срібного електрода Ехс становить 0, 2010 В. Мідний електрод, занурений в розчин солі купруму є електродом І-роду. Його потенціал залежить від природи потенціалвизначуваниї пари і концентрації катіона Cu2+ (окисленої форми).
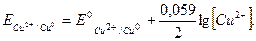
Концентрацію іона Cu2+ визначають за співвідношенням

де m – маса солі; М – молярна маса солі, г/моль; V – об¢ єм розчину, в якому міститься сіль, л.
М [ Cu(NO3)2× 3H2O] = 241, 6 г/моль; V = 0, 150 л.
|
|
|
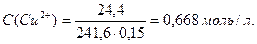
Підставимо значення С(Cu2+) у рівняння Нернста:

Потенціал одного електрода відносно іншого визначають як різницю потенціалів цих електродів, виміряних відносно стандартного водневого, при цьому завжди від більшої величини віднімають меншу.
Отже, ЕРС елемента, складеного із мідного та насиченого хлоридсрібного електродів:

Відповідь: 0, 139 В.
Приклад 2. Розрахувати потенціал срібного електрода в розчині, насиченому хлоридом срібла, з активністю хлорид-іонів 1 моль/л для електродної реакції:

Розв'язування
Виходячи з ДРAgCl=1, 75× 10-10 можна розрахувати активність іонів срібла:

Підставляючи цей вираз в рівняння Нернста одержимо:
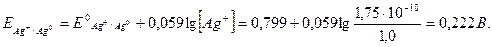
Фактично ця величина описує залежність потенціалу срібного електрода від активності хлорид-іонів у розчині, насиченому хлоридом срібла. За умов, що активність іонів хлориду складає 1 моль/л, потенціал срібного електрода дорівнює сумі двох констант і може розглядатися як потенціал напівреакції:
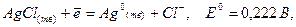
де

Рівняння Нернста для срібного електрода в розчині, насиченому хлоридом срібла, можна записати у вигляді:

Аналогічним способом можна виразити потенціал срібного електрода в розчині, який містить іон, що утворює з іоном срібла розчинний комплекс. Наприклад, у розчині, що містить тіосульфат-іон, має місце напівреакція:

Стандартний електродний потенціал цієї напівреакції за умови, що активності комплексу і ліганду рівні (моль/л), дорівнює:


де b- константа стійкості комплексу.
Відповідь: 0, 222 В.
Приклад 3. Потенціал хінгідронного електрода відносно нормального каломельного дорівнює 0, 170 В за температурою 200С. Обчислити рН розчину, в який занурений хінгідронний електрод.
Розв’язування
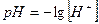 .
.
Потенціал хінгідронного електрода (Ехге), якщо t=200С, зв¢ язаний з концентрацією іонів гідрогену в розчині (або рН) рівнянням
|
|
|
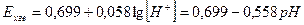
Електрорушійна сила елемента, складеного з хінгідронного (Ехге) та каломельного (Енке) електродів:
Е = Ехге- Енке = 0, 170 В.
Оскільки, Енке= 0, 282 В:
0, 170 = 0, 699 – 0, 058 рН – 0, 282
рН = (0, 699 – 0, 282 – 0, 170)/0, 058 = 4, 26
Відповідь: 4, 26.
Приклад 4. Побудувати криві потенціометричного титрування в координатах рН-V і DрН/DV-V та визначити концентрацію ацетатної кислоти, якщо під час титрування 10, 0 мл аналізованого розчину кислоти 0, 5000М розчином NaOH одержані такі результати:
| VNaOH, мл | 10, 0 | 15, 0 | 18, 0 | 19, 0 | 19, 9 | 20, 0 | 20, 1 | 20, 5 | 21, 0 |
| рН | 4, 80 | 5, 30 | 5, 70 | 6, 05 | 6, 35 | 7, 10 | 10, 05 | 11, 20 | 11, 25 |
Розв’язування
Будуємо криві потенціометричного титрування в кординатах рН-V і DрН/DV-V. Визначаємо, що об¢ єм титранту в точці еквівалентності на кривій рН-V дорівнює 20, 0 мл. Максимум кривої в координатах DрН/DV-V також відповідає – 20, 0 мл. За законом еквівалентів обчислюємо концентрацію кислоти:
10× СхN = 0, 1500× 20, 0
СхN = 0, 1500× 20, 0/10, 0 = 0, 3000 М.
Відповідь: 0, 3000 М.
Приклад 5. Обчислити потенціал платинового електрода, зануреного в розчин FeSO4, на 99% відтитрований розчином КMnO4.
Розв’язування
Потенціал платинового електрода, який є інертним залежить від природи окисно-відновної пари та концентрацій окисненої й відновленої форм. У розчині є пара:
Fe3++e = Fe2+,
для якої 

Якщо вихідний розчин відтитровують на 99%, то

Отже,

Відповідь: 0, 888 В.
|
|
|


